解题方法
1 . 由Sn、V、Gd等元素组成钒基笼目金属在超导电性方面有广阔的应用前景。回答下列问题:
(1)Sn与C同主族,基态Sn原子的价电子排布式为___________ ,Sn和Cl2反应会生成SnCl2和SnCl4。SnCl2(s)以线性聚合状态存在,其结构如图。

Cl-Sn-Cl键角:SnCl2(s)___________ SnCl4(填“>”或“<”),原因是___________ 。
(2)基态V原子的价电子中,未成对电子数与成对电子数之比为___________ ;钒有+2、+3、+4、+5等多种化合价,从原子结构角度分析最稳定的化合价是___________ ;将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列含V物质中,属于顺磁性物质的是___________ (填标号)。
A.VF4 B.V(NH3)3Cl3 C.Na3VO4 D.Na4[V(CN)6]
(3)已知钒基笼目金属的晶体结构如图。该钒基笼目金属的化学式为___________ ,1号、2号Sn原子间的距离为___________ pm。

(1)Sn与C同主族,基态Sn原子的价电子排布式为

Cl-Sn-Cl键角:SnCl2(s)
(2)基态V原子的价电子中,未成对电子数与成对电子数之比为
A.VF4 B.V(NH3)3Cl3 C.Na3VO4 D.Na4[V(CN)6]
(3)已知钒基笼目金属的晶体结构如图。该钒基笼目金属的化学式为

您最近一年使用:0次
名校
解题方法
2 . 现有A、B、C、D、E、F、G、H共8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题:
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,B元素是形成化合物种类最多的元素,C元素基态原子的核外p能级电子数比s能级电子数少1,D元素基态原子的核外p轨道中有两个未成对电子,E元素的气态基态原子的第一至第四电离能分别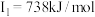 ,
,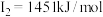 ,
,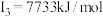 ,
,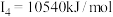 ,F元素的主族序数与周期数的差为4,G元素是前四周期中电负性最小的元素,H元素位于元素周期表中的第8列
,F元素的主族序数与周期数的差为4,G元素是前四周期中电负性最小的元素,H元素位于元素周期表中的第8列
(1) 的电子式为
的电子式为___________ (A、C为字母代号,请将字母代号用元素符号表示,下同)。
(2)B元素的原子核外共有___________ 种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈___________ 形。
(3)某同学推断E元素基态原子的核外电子轨道表示式为 ,该同学所画的电子轨道表示式违背了
,该同学所画的电子轨道表示式违背了___________ ,该元素的 远远大于
远远大于 ,其原因是
,其原因是___________ 。
(4)D、E、F三种元素的简单离子半径由大到小的顺序是___________ ,若要检测某未知溶液中是否含有F的—1价离子,需要用到的检测试剂为___________ 。
(5)H位于元素周期表中___________ 区(按电子排布分区),其+2价离子的价电子排布式为___________ 。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,B元素是形成化合物种类最多的元素,C元素基态原子的核外p能级电子数比s能级电子数少1,D元素基态原子的核外p轨道中有两个未成对电子,E元素的气态基态原子的第一至第四电离能分别
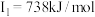 ,
,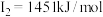 ,
,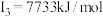 ,
,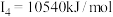 ,F元素的主族序数与周期数的差为4,G元素是前四周期中电负性最小的元素,H元素位于元素周期表中的第8列
,F元素的主族序数与周期数的差为4,G元素是前四周期中电负性最小的元素,H元素位于元素周期表中的第8列(1)
 的电子式为
的电子式为(2)B元素的原子核外共有
(3)某同学推断E元素基态原子的核外电子轨道表示式为
 ,该同学所画的电子轨道表示式违背了
,该同学所画的电子轨道表示式违背了 远远大于
远远大于 ,其原因是
,其原因是(4)D、E、F三种元素的简单离子半径由大到小的顺序是
(5)H位于元素周期表中
您最近一年使用:0次
解题方法
3 . 硫、锌及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)硫元素的三种微粒电子排布式分别为①[Ne]3s23p4②[Ne]3s23p3③[Ne]3s23p34s1,下列叙述正确的是_(填标号)。
(2)基态S原子核外电子的空间运动状态有___________ 种,基态Zn原子核外能量不同的电子有___________ 种。
(3)许多物质的氧化物固态存在多聚体,例如:五氧化二磷实际的分子式是P4O10。根据下表,推测固态三氧化硫实际的分子式为___________ 。
(4)咪唑( )具有平面结构,其中①号N原子能与Zn2+形成配位键,②号N原子不能形成的原因是
)具有平面结构,其中①号N原子能与Zn2+形成配位键,②号N原子不能形成的原因是___________ 。
(5)ZnS晶体属于立方晶系,晶胞及其投影图如图所示,Zn2+的配位数为___________ ;A点原子的分数坐标为(0,0,0),B点原子的分数坐标为( ,1,
,1, ),则C点原子的分数坐标为
),则C点原子的分数坐标为___________ ;晶胞中S2-与其最近的Zn2+的距离是___________ 为dnm,密度为pg/cm3,阿伏加德罗常数NA为___________ mol-1(用含d、p的代数式表示)。

(1)硫元素的三种微粒电子排布式分别为①[Ne]3s23p4②[Ne]3s23p3③[Ne]3s23p34s1,下列叙述正确的是_(填标号)。
| A.微粒半径:③>①>② | B.电子排布属于基态的是:①② |
| C.电离一个电子所需最低能量:①>②>③ | D.得电子能力:①>② |
(2)基态S原子核外电子的空间运动状态有
(3)许多物质的氧化物固态存在多聚体,例如:五氧化二磷实际的分子式是P4O10。根据下表,推测固态三氧化硫实际的分子式为
| 物质 | P4O10 | 三氧化硫 | Cl2O7 |
| 熔点 | 613K | 289K | 182K |
(4)咪唑(
 )具有平面结构,其中①号N原子能与Zn2+形成配位键,②号N原子不能形成的原因是
)具有平面结构,其中①号N原子能与Zn2+形成配位键,②号N原子不能形成的原因是(5)ZnS晶体属于立方晶系,晶胞及其投影图如图所示,Zn2+的配位数为
 ,1,
,1, ),则C点原子的分数坐标为
),则C点原子的分数坐标为
您最近一年使用:0次
名校
解题方法
4 . 中国的稀土储量世界第一、稀土元素是周期系ⅢB族中原子序数为21 (Sc)、39(Y)和镧系元素共17种化学元素的统称。稀土元素的共性是原子结构相似、离子半径相近、它们在自然界大多以氧化物形态密切共生。请回答下列问题:

(1)“稀土元素”常见的化合价为___________ 。
(2)“镧系元素”在周期表中的位置是___________ 区(填写“s、p、d、f、ds”)。
(3)写出钇(Y)的基态原子的电子排布式___________ ,其基态原子失去第一个电子的能级符号是___________ 。
(4)钪(Sc)元素的最高能层符号是___________ ,有___________ 种运动状态不同的电子。
(5)稀土金属的冶炼在提纯后可以采用电解熔融氯化物或氧化物的方法制取。说明该氯化物或氧化物属于___________ (填“离子”、“共价”)化合物。除Pm(钷)以外的16种稀土元素都可以提纯到6N(99.9999%)的纯度。由稀土精矿分解后所得到的混合稀土化合物中,分离提取出单-纯稀土元素,在化学工艺上是比较复杂和困难的。其原因除了矿石中杂质伴生元素种类较多之外,主要还是___________ 。
(6)稀土元素分组方法之一是两分法[轻稀土和重稀土]。两分法分组以Gd (钆)划界的原因是:从Gd开始在4f亚层上新增加电子的自旋方向改变了,则Gd的4f能级价层电子排布图为___________ 。

(1)“稀土元素”常见的化合价为
(2)“镧系元素”在周期表中的位置是
(3)写出钇(Y)的基态原子的电子排布式
(4)钪(Sc)元素的最高能层符号是
(5)稀土金属的冶炼在提纯后可以采用电解熔融氯化物或氧化物的方法制取。说明该氯化物或氧化物属于
(6)稀土元素分组方法之一是两分法[轻稀土和重稀土]。两分法分组以Gd (钆)划界的原因是:从Gd开始在4f亚层上新增加电子的自旋方向改变了,则Gd的4f能级价层电子排布图为
您最近一年使用:0次
解题方法
5 . 第VA族元素及其化合物在工业生产中起着重要的作用。
(1)氮原子的电子排布图表示的状态中,能量由低到高的顺序是_______ (填字母代号)。
A. B.
B.
C. D.
D.
(2)已知 是次磷酸的正盐,
是次磷酸的正盐, 的结构式为
的结构式为_______ 。
(3)黑磷与石墨类似,也具有层状结构(图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷—石墨复合负极材料,其单层结构俯视图如图2所示。

根据图1和图2的信息,下列说法错误的是_______(填字母)。
(4) 分子空间结构为
分子空间结构为_______ , 与
与 反应生成
反应生成 ,
, 结构为
结构为 ,
, 是
是_______ (填“极性”或“非极性”)分子。
(5)已知有关氮、磷的单键和三键的键能( )如下表:
)如下表:
从能量角度分析,氮以 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为 )形式存在的原因是
)形式存在的原因是_______ 。
(6) 、
、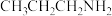 、
、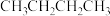 三种物质熔点由高到低排序
三种物质熔点由高到低排序_______ ,说明原因_______ 。
(1)氮原子的电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B.
C.
 D.
D.
(2)已知
 是次磷酸的正盐,
是次磷酸的正盐, 的结构式为
的结构式为(3)黑磷与石墨类似,也具有层状结构(图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷—石墨复合负极材料,其单层结构俯视图如图2所示。

根据图1和图2的信息,下列说法错误的是_______(填字母)。
A.黑磷区中 键的键能不完全相同 键的键能不完全相同 |
| B.黑磷与石墨都属于混合型晶体 |
| C.由石墨与黑磷制备该复合材料的过程,发生了化学反应 |
| D.复合材料单层中,P原子与C原子之间的作用力属范德华力 |
 分子空间结构为
分子空间结构为 与
与 反应生成
反应生成 ,
, 结构为
结构为 ,
, 是
是(5)已知有关氮、磷的单键和三键的键能(
 )如下表:
)如下表: |  |  |  |
| 193 | 946 | 197 | 489 |
 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为 )形式存在的原因是
)形式存在的原因是(6)
 、
、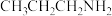 、
、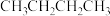 三种物质熔点由高到低排序
三种物质熔点由高到低排序
您最近一年使用:0次
解题方法
6 . 铁、钴及其化合物在生产生活中用途广泛。请回答下列问题:
(1)第四周期元素中,基态原子未成对电子数与 相等的有
相等的有___________ (填元素符号)。
(2) 在氨水中能形成多种配合物。八面体配合物
在氨水中能形成多种配合物。八面体配合物 的结构有
的结构有___________ 种。取 ,加入足量硝酸银溶液,得到
,加入足量硝酸银溶液,得到 白色沉淀。该物质在溶液中形成的配离子的化学式为
白色沉淀。该物质在溶液中形成的配离子的化学式为___________ 。
(3)铁和氨在640℃时可发生置换反应,一种产物的晶胞结构如图所示,该反应的化学方程式为___________ 。 。铁-氰骨架组成小立方体,
。铁-氰骨架组成小立方体, 粒子在顶点,
粒子在顶点, 在小正方体的棱上,两端均与
在小正方体的棱上,两端均与 相连,立方体中心空隙可容纳
相连,立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。
在图中省略)。___________ 。若所有铁粒子为等径小球,则 与
与 之间最近距离为
之间最近距离为___________  。该晶体的密度为
。该晶体的密度为___________  (阿伏加德罗常数为
(阿伏加德罗常数为 )
)
(1)第四周期元素中,基态原子未成对电子数与
 相等的有
相等的有(2)
 在氨水中能形成多种配合物。八面体配合物
在氨水中能形成多种配合物。八面体配合物 的结构有
的结构有 ,加入足量硝酸银溶液,得到
,加入足量硝酸银溶液,得到 白色沉淀。该物质在溶液中形成的配离子的化学式为
白色沉淀。该物质在溶液中形成的配离子的化学式为(3)铁和氨在640℃时可发生置换反应,一种产物的晶胞结构如图所示,该反应的化学方程式为

 。铁-氰骨架组成小立方体,
。铁-氰骨架组成小立方体, 粒子在顶点,
粒子在顶点, 在小正方体的棱上,两端均与
在小正方体的棱上,两端均与 相连,立方体中心空隙可容纳
相连,立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。
在图中省略)。
 与
与 之间最近距离为
之间最近距离为 。该晶体的密度为
。该晶体的密度为 (阿伏加德罗常数为
(阿伏加德罗常数为 )
)
您最近一年使用:0次
名校
解题方法
7 . 下图为元素周期表的部分,元素①~⑥在表中的位置如图所示。

用化学用语 回答下列问题:
(1)元素⑤的基态原子核外共有___________ 个单电子,元素⑥的基态原子价电子排布式为___________ 。
(2)元素③、④的简单氢化物中,稳定性较高的是______ (填化学式),原因是_______ 。
(3)元素①与元素②、③均能形成18e-分子,其中与②形成的18e-分子的结构式为___________ ,一定条件下两种18e-分子能发生反应,产物无污染,写出该反应的化学方程式___________ 。
(4)单质⑤的晶胞结构如图所示,平均一个晶胞中含有___________ 个⑤原子,若⑤原子的原子半径为r,则该晶体的空间利用率为___________ 。(用含r的代数式表示,不必化简)


用
(1)元素⑤的基态原子核外共有
(2)元素③、④的简单氢化物中,稳定性较高的是
(3)元素①与元素②、③均能形成18e-分子,其中与②形成的18e-分子的结构式为
(4)单质⑤的晶胞结构如图所示,平均一个晶胞中含有

您最近一年使用:0次
解题方法
8 . 磷、钠、铁等元素形成的化合物在生产、科研中应用广泛。回答下列问题:
(1)基态原子未成对电子数与基态P相同,且与 同周期的元素有
同周期的元素有___________ 种;第三周期主族元素部分电离能如图所示,其中a、b和c分别代表___________ (填标号)。

A.a为 、b为
、b为 、c为
、c为 B.a为
B.a为 、b为
、b为 、c为
、c为
C.a为 、b为
、b为 、c为
、c为 D.a为
D.a为 、b为
、b为 、c为
、c为
(2)锂离子电池正极材料 ,结构中
,结构中 八面体与
八面体与 四面体共用氧原子形成稳定的三维通道,有利于
四面体共用氧原子形成稳定的三维通道,有利于 快速传输。
快速传输。 与
与 结构相似,但
结构相似,但 不能用作钠离子电池正极材料,从原子结构角度分析可能的原因是
不能用作钠离子电池正极材料,从原子结构角度分析可能的原因是___________ 。
(3) 能在有机溶剂中发生电离,生成空间结构相同的阴、阳离子,阳离子的化学式为
能在有机溶剂中发生电离,生成空间结构相同的阴、阳离子,阳离子的化学式为___________ ,阴离子中心原子的杂化方式为___________ 。
(4)常温下 黏度很大,温度升高,黏度降低,原因是
黏度很大,温度升高,黏度降低,原因是___________ 。
(5)在超高压下,金属钠和氦可形成化合物 。该化合物中,
。该化合物中, 按简单立方排布,形成
按简单立方排布,形成 立方体空隙(部分结构如图所示),
立方体空隙(部分结构如图所示),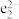 和
和 交替填充在
交替填充在 立方体的中心。晶体中
立方体的中心。晶体中 配位的
配位的 原子数为
原子数为___________ :晶胞中 间距为
间距为 ,该晶体的密度为
,该晶体的密度为___________  ;若将
;若将 取在晶胞顶点,
取在晶胞顶点,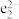 在晶胞中的分数坐标为(0,0,
在晶胞中的分数坐标为(0,0, )、(
)、( ,0,0)、
,0,0)、___________ 和___________ 。

(1)基态原子未成对电子数与基态P相同,且与
 同周期的元素有
同周期的元素有
A.a为
 、b为
、b为 、c为
、c为 B.a为
B.a为 、b为
、b为 、c为
、c为
C.a为
 、b为
、b为 、c为
、c为 D.a为
D.a为 、b为
、b为 、c为
、c为
(2)锂离子电池正极材料
 ,结构中
,结构中 八面体与
八面体与 四面体共用氧原子形成稳定的三维通道,有利于
四面体共用氧原子形成稳定的三维通道,有利于 快速传输。
快速传输。 与
与 结构相似,但
结构相似,但 不能用作钠离子电池正极材料,从原子结构角度分析可能的原因是
不能用作钠离子电池正极材料,从原子结构角度分析可能的原因是(3)
 能在有机溶剂中发生电离,生成空间结构相同的阴、阳离子,阳离子的化学式为
能在有机溶剂中发生电离,生成空间结构相同的阴、阳离子,阳离子的化学式为(4)常温下
 黏度很大,温度升高,黏度降低,原因是
黏度很大,温度升高,黏度降低,原因是(5)在超高压下,金属钠和氦可形成化合物
 。该化合物中,
。该化合物中, 按简单立方排布,形成
按简单立方排布,形成 立方体空隙(部分结构如图所示),
立方体空隙(部分结构如图所示),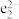 和
和 交替填充在
交替填充在 立方体的中心。晶体中
立方体的中心。晶体中 配位的
配位的 原子数为
原子数为 间距为
间距为 ,该晶体的密度为
,该晶体的密度为 ;若将
;若将 取在晶胞顶点,
取在晶胞顶点,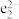 在晶胞中的分数坐标为(0,0,
在晶胞中的分数坐标为(0,0, )、(
)、( ,0,0)、
,0,0)、
您最近一年使用:0次
名校
解题方法
9 . 由于锂离子电池成本的日益上涨以及锂资源的不断消耗,钾离子电池成为近几年的研究热点。回答下列问题:
(1)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的负极电极材料。
①已知锑(Sb)为第五周期元素,与氮同族,Sb有___________ 个未成对电子。
②已知 和KCl的熔点分别是73.4℃和770℃,请分析两种物质熔点差异的原因:
和KCl的熔点分别是73.4℃和770℃,请分析两种物质熔点差异的原因:___________ 。
(2)过渡金属氧化物在钾离子电池正极材料中得到广泛应用,例如碳包覆的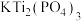 纳米材料,
纳米材料, 中P的杂化类型为
中P的杂化类型为___________ ,该金属盐中不存在的微粒间作用力有___________ (填标号)。
a.σ键 b.离子键 c.金属键 d.氢键
(3)该锑钾(Sb-K)合金的晶胞结构如图a,图b表示晶胞的一部分。

①设1号原子的分数坐标为(0,0,0),2号原子的分数坐标为(1,1,1),则3号原子的分数坐标为___________ 。
②与Sb最邻近的K原子数为___________ ,若K原子的半径为a pm,Sb原子的半径为b pm,则该晶体中原子的空间利用率为___________ (用含a、b的计算表达式表示)。
(1)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的负极电极材料。
①已知锑(Sb)为第五周期元素,与氮同族,Sb有
②已知
 和KCl的熔点分别是73.4℃和770℃,请分析两种物质熔点差异的原因:
和KCl的熔点分别是73.4℃和770℃,请分析两种物质熔点差异的原因:(2)过渡金属氧化物在钾离子电池正极材料中得到广泛应用,例如碳包覆的
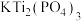 纳米材料,
纳米材料, 中P的杂化类型为
中P的杂化类型为a.σ键 b.离子键 c.金属键 d.氢键
(3)该锑钾(Sb-K)合金的晶胞结构如图a,图b表示晶胞的一部分。

①设1号原子的分数坐标为(0,0,0),2号原子的分数坐标为(1,1,1),则3号原子的分数坐标为
②与Sb最邻近的K原子数为
您最近一年使用:0次
2023-03-30更新
|
249次组卷
|
4卷引用:山东省名校联盟2022-2023学年高二下学期3月质量检测联合调考化学(B1)试题
名校
解题方法
10 . 周期表前四周期的元素X、Y、Z、W,原子序数依次增大,X原子基态时L层中P轨道电子数与s轨道电子数相同;Y原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
(1)X位于周期表的第_______ 周期,第_______ 族。
(2)元素的第一电离能:X_______ Y(填“>”或“<”,下同);原子半径:X_______ Y。
(3)Y的最高价氧化物对应水化物中酸根离子的空间构型是_______ (用文字描述)。
(4)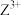 基态核外电子排布式为
基态核外电子排布式为_______ ,用铁氰化钾溶液检验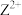 的离子方程式为
的离子方程式为_______ 。
(1)X位于周期表的第
(2)元素的第一电离能:X
(3)Y的最高价氧化物对应水化物中酸根离子的空间构型是
(4)
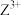 基态核外电子排布式为
基态核外电子排布式为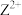 的离子方程式为
的离子方程式为
您最近一年使用:0次



