名校
解题方法
1 . 氟化镁钾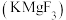 是一种具有优良光学性能的材料,其晶胞结构如图。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
是一种具有优良光学性能的材料,其晶胞结构如图。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。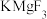 晶体中,每个
晶体中,每个 周围有
周围有__________ 个距离最近的 。
。
②已知晶胞棱长为a nm,则该晶胞的密度为__________  (用含a的代数式表示计算结果,
(用含a的代数式表示计算结果,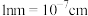 ,
,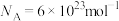 ,下同)。
,下同)。
③已知 与
与 离子半径相近,从原子结构角度解释原因
离子半径相近,从原子结构角度解释原因__________ 。
(2) 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态 中未成对的电子数为
中未成对的电子数为__________ 。
②某实验室合成新型催化剂材料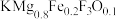 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。若要合成厚度为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。若要合成厚度为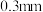 、面积为
、面积为 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为__________ mol。
(3)我国科研工作者以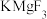 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子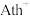 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。
。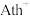 与
与 的结构简式分别为
的结构简式分别为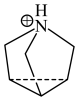 和
和 。
。
① 中心N原子的杂化方式为
中心N原子的杂化方式为__________ 。
②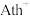 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在其他相互作用,如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在其他相互作用,如邻近的 与
与 间还存在
间还存在__________ ,上述相互作用不会随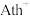 的转动改变。
的转动改变。
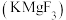 是一种具有优良光学性能的材料,其晶胞结构如图。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
是一种具有优良光学性能的材料,其晶胞结构如图。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。 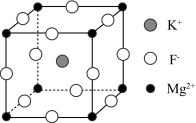
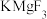 晶体中,每个
晶体中,每个 周围有
周围有 。
。②已知晶胞棱长为a nm,则该晶胞的密度为
 (用含a的代数式表示计算结果,
(用含a的代数式表示计算结果, ,
,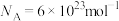 ,下同)。
,下同)。③已知
 与
与 离子半径相近,从原子结构角度解释原因
离子半径相近,从原子结构角度解释原因(2)
 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。①基态
 中未成对的电子数为
中未成对的电子数为②某实验室合成新型催化剂材料
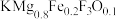 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。若要合成厚度为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。若要合成厚度为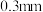 、面积为
、面积为 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为(3)我国科研工作者以
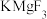 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子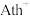 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。
。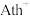 与
与 的结构简式分别为
的结构简式分别为 和
和 。
。①
 中心N原子的杂化方式为
中心N原子的杂化方式为②
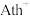 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在其他相互作用,如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在其他相互作用,如邻近的 与
与 间还存在
间还存在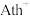 的转动改变。
的转动改变。
您最近一年使用:0次
名校
解题方法
2 . 神舟飞船材料由金属材料(镁合金、钛合金、铝合金等)和非金属材料加工而成。
(1)钛具有较强抗腐蚀性及强度。
①基态钛原子的核外电子排布式为___________ 。
②电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的则用-
表示,与之相反的则用- 表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为___________ 。
③从原子结构角度解释TiCl3中+3价钛元素还原性较强的原因___________ 。
④Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________ 。
(2)氧化锆基陶瓷热障涂层是航天发动机的关键技术。下图为立方氧化锆晶胞示意图。___________ 。
②每个Zr原子周围紧邻的等距Zr原子有___________ 个。
(1)钛具有较强抗腐蚀性及强度。
①基态钛原子的核外电子排布式为
②电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的则用-
表示,与之相反的则用- 表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为③从原子结构角度解释TiCl3中+3价钛元素还原性较强的原因
④Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | - 24.12 | 38.3 | 155 |

②每个Zr原子周围紧邻的等距Zr原子有
您最近一年使用:0次
名校
解题方法
3 . 下图是元素周期表的一部分,图中所列字母分别代表一种化学元素。
(1)元素e位于周期表中______ 区,其基态原子核外有______ 种运动状态不同的电子。
(2)基态c原子中有______ 个未成对电子,其中能量最高的电子所在原子轨道的电子云轮廓图为______ 形
(3)b、c、d三种元素的第一电离能由大到小的顺序为______ (填元素符号);b、c、d三种元素中能形成氢键的是______ (填元素符号)。
(4)已知高温下化合物f2d比化合物fd更稳定,试从核外电子排布的角度解释原因______ 。

(1)元素e位于周期表中
(2)基态c原子中有
(3)b、c、d三种元素的第一电离能由大到小的顺序为
(4)已知高温下化合物f2d比化合物fd更稳定,试从核外电子排布的角度解释原因
您最近一年使用:0次
2024-01-02更新
|
81次组卷
|
2卷引用:北京市大兴区2022-2023学年大兴一中高二上学期期中考试(1+3学部)
名校
解题方法
4 . 金属Ni可以与Mg、C形成一种化合物M,M是一种新型超导体,它的临界温度为8K。回答下列问题:
(1)在基态Mg原子中,核外存在______ 对自旋相反的电子。
(2)碳在矿物中,通常以碳酸盐形式存在。根据价层电子对互斥理论,可推知 的空间构型为
的空间构型为______ ,其中碳原子的杂化轨道类型为______ 。NaHCO3的溶解度比Na2CO3的小,其原因是 在水溶液中易形成多聚离子,请解释
在水溶液中易形成多聚离子,请解释 形成多聚离子的原因是
形成多聚离子的原因是______ 。
(3)Ni的基态原子的价层电子排布式为______ 。区分晶体Ni和非晶体Ni的最可靠的科学方法为______ 。
(4)已知M的晶胞为棱长为dpm的立方体结构(如下图所示),则该晶体的密度为______ g/cm-3(列出计算式)

(1)在基态Mg原子中,核外存在
(2)碳在矿物中,通常以碳酸盐形式存在。根据价层电子对互斥理论,可推知
 的空间构型为
的空间构型为 在水溶液中易形成多聚离子,请解释
在水溶液中易形成多聚离子,请解释 形成多聚离子的原因是
形成多聚离子的原因是(3)Ni的基态原子的价层电子排布式为
(4)已知M的晶胞为棱长为dpm的立方体结构(如下图所示),则该晶体的密度为

您最近一年使用:0次
名校
解题方法
5 . 某小组实验探究铜与浓硫酸的反应。
资料:i.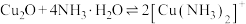 (极浅蓝色)
(极浅蓝色)
ii.硫化铜和硫化亚铜常温下都不溶于稀盐酸,易溶于浓盐酸
iii.单质硫不溶于水,微溶于酒精
iv. 在干燥环境(浓
在干燥环境(浓 )中较为稳定
)中较为稳定

(1)浓 与Cu制备
与Cu制备 的化学方程式是
的化学方程式是___________ 。
(2)上述实验中能证明浓硫酸中硫酸分子的氧化性强于氢离子的实验证据是___________ 。
实验过程中,小组同学按加热时间分为三个阶段,记录实验现象如下:
(3)经检验阶段一中铜丝表面逐渐变黑的产物为 ,请从物质性质和结构角度解释产生
,请从物质性质和结构角度解释产生 原因是
原因是___________ ,发生的主要反应化学方程式是___________ 。
小组同学为探究实验中产生的沉淀,设计如下实验方案。
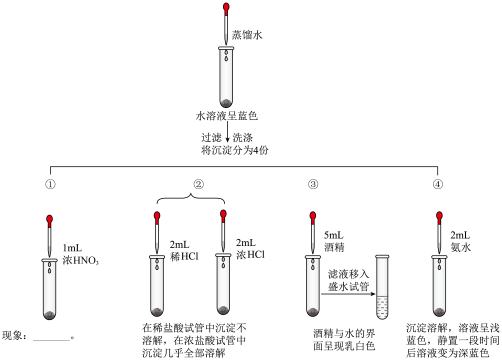
(4)实验①中可观察到的实验现象是___________ 。
(5)请用化学用语描述实验④中溶液由浅蓝色变为深蓝色的原因___________ 。
(6)通过上述实验验证可知,铜与浓硫酸反应后生成的沉淀主要成分有___________ 。
资料:i.
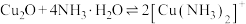 (极浅蓝色)
(极浅蓝色)
ii.硫化铜和硫化亚铜常温下都不溶于稀盐酸,易溶于浓盐酸
iii.单质硫不溶于水,微溶于酒精
iv.
 在干燥环境(浓
在干燥环境(浓 )中较为稳定
)中较为稳定
(1)浓
 与Cu制备
与Cu制备 的化学方程式是
的化学方程式是(2)上述实验中能证明浓硫酸中硫酸分子的氧化性强于氢离子的实验证据是
实验过程中,小组同学按加热时间分为三个阶段,记录实验现象如下:
| 反应阶段 | 阶段一(加热初期) | 阶段二(继续加热) | 阶段三(加热后期) |
| 实验现象 | 铜丝表面逐渐变黑,溶液接近无色,无气体生成 | 大量刺激性气体产生,溶液变为墨绿色,试管底部产生灰白色沉淀 | 试管中出现“白雾”,浊液逐渐变澄清,溶液变为浅蓝,灰白色沉淀增多 |
(3)经检验阶段一中铜丝表面逐渐变黑的产物为
 ,请从物质性质和结构角度解释产生
,请从物质性质和结构角度解释产生 原因是
原因是小组同学为探究实验中产生的沉淀,设计如下实验方案。

(4)实验①中可观察到的实验现象是
(5)请用化学用语描述实验④中溶液由浅蓝色变为深蓝色的原因
(6)通过上述实验验证可知,铜与浓硫酸反应后生成的沉淀主要成分有
您最近一年使用:0次
2023-11-25更新
|
392次组卷
|
2卷引用:北京市通州区2023-2024学年高三上学期期中质量检测化学试题
6 . N元素能形成多种化合物,它们之间可以发生相互转化,如:N2H4+HNO2=2H2O+HN3,请回答下列问题:
(1)N的基态原子的电子排布中,有_______ 个运动状态不同的未成对电子。
(2)叠氮酸(HN3)在常温下是液体,沸点相对较高,为308.8 K,主要原因是_______ 。
(3)HNO2中N原子的杂化类型是_______ ,NO 的空间结构为
的空间结构为_______ 。
(4)①NO 是一种很好的配体,则能提供孤电子对的
是一种很好的配体,则能提供孤电子对的_______ (填字母)。
A.仅有氧原子 B.仅有氮原子 C.是氧原子或氮原子
②NO 与钴盐通过配位键形成的[Co(NO2)6]3-能与K+结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+,写出该配合物中钴离子的电子排布式:
与钴盐通过配位键形成的[Co(NO2)6]3-能与K+结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+,写出该配合物中钴离子的电子排布式:_______ 。
(5)N2H4分子中_______ (填“含有”或“不含”)π键。
(1)N的基态原子的电子排布中,有
(2)叠氮酸(HN3)在常温下是液体,沸点相对较高,为308.8 K,主要原因是
(3)HNO2中N原子的杂化类型是
 的空间结构为
的空间结构为(4)①NO
 是一种很好的配体,则能提供孤电子对的
是一种很好的配体,则能提供孤电子对的A.仅有氧原子 B.仅有氮原子 C.是氧原子或氮原子
②NO
 与钴盐通过配位键形成的[Co(NO2)6]3-能与K+结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+,写出该配合物中钴离子的电子排布式:
与钴盐通过配位键形成的[Co(NO2)6]3-能与K+结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+,写出该配合物中钴离子的电子排布式:(5)N2H4分子中
您最近一年使用:0次
名校
解题方法
7 . d区金属元素钛有“太空金属”“未来金属”等美誉,在航空航天、海洋产业等行业有重要作用。回答下列问题:
(1)基态钛原子的核外电子排布式为____ 。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的则用-
表示,与之相反的则用- 表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为____ 。
(3)如图所示的晶体结构是一种基础无机介电材料的最小结构单元(晶胞),这种晶体材料的化学式为_____ 。

(4)我国科学家用Mg3N2和TiCl4制备超导材料TiN,理论分析可能的反应 为:
Mg3N2+2TiCl4=2TiN+3MgCl2+Cl2↑ Ⅰ
4Mg3N2+6TiCl4=6TiN+12MgCl2+N2↑ Ⅱ
已知:ⅰ.部分物质的熔沸点
ⅱ.TiCl4能和NaOH溶液反应。
制备TiN的关键步骤如下:600℃时,将TiCl4按0.2L/min的速率通入盛有Mg3N2的刚玉坩埚内,当TiCl4适当过量后停止通入,在N2中冷却至室温。
科学家通过测定不同时间段尾气处理装置中钛和氯的质量百分含量,进而确定生成TiN反应的化学方程式。


①TiCl4属于____ 晶体。
②结合上图,判断制备TiN的反应是“Ⅰ”还是“Ⅱ”,并说明判断依据_____ 。
(1)基态钛原子的核外电子排布式为
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的则用-
表示,与之相反的则用- 表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为(3)如图所示的晶体结构是一种基础无机介电材料的最小结构单元(晶胞),这种晶体材料的化学式为

(4)我国科学家用Mg3N2和TiCl4制备超导材料TiN,理论分析
Mg3N2+2TiCl4=2TiN+3MgCl2+Cl2↑ Ⅰ
4Mg3N2+6TiCl4=6TiN+12MgCl2+N2↑ Ⅱ
已知:ⅰ.部分物质的熔沸点
| Mg3N2 | TiCl4 | MgCl2 | TiN | |
| 熔点/℃ | 800(分解) | -25 | 714 | 2950 |
| 沸点/℃ | 700(升华) | 136.4 | 1412 | (略) |
制备TiN的关键步骤如下:600℃时,将TiCl4按0.2L/min的速率通入盛有Mg3N2的刚玉坩埚内,当TiCl4适当过量后停止通入,在N2中冷却至室温。
科学家通过测定不同时间段尾气处理装置中钛和氯的质量百分含量,进而确定生成TiN反应的化学方程式。


①TiCl4属于
②结合上图,判断制备TiN的反应是“Ⅰ”还是“Ⅱ”,并说明判断依据
您最近一年使用:0次
2022-01-17更新
|
348次组卷
|
3卷引用:北京市石景山区2021-2022学年高三上学期期末考试化学试题
名校
解题方法
8 . 常见的太阳能电池有硅太阳能电池、镓(Ga)砷(As)太阳能电池及铜铟镓硒薄膜太阳能电池等。下列有关它们的化合物的问题,请回答:
(1)基态Ga原子的电子排布式为________ ;H2O的沸点高于H2Se的沸点(-42℃),其原因是__________ 。
(2)Na3AsO4中阴离子的空间构型为________ ,As原子采取________ 杂化。
(3)晶体Si、SiC、SiO2都属于原子晶体,请写出它们的熔点从高到低的顺序排列________ 。
(4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因______________ 。
(5)银与铜位于同一副族。氟化银具有氯化钠型结构,其中的阴离子采用面心立方最密堆积方式,氯化钠的晶胞结构如图所示。则Ag+周围等距离且最近的F−在空间围成的几何构型为_______ ,已知氟化银的密度为d g·cm−3,则氟化银晶胞的晶胞参数为_______ nm(不必简化)。

(1)基态Ga原子的电子排布式为
(2)Na3AsO4中阴离子的空间构型为
(3)晶体Si、SiC、SiO2都属于原子晶体,请写出它们的熔点从高到低的顺序排列
(4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因
(5)银与铜位于同一副族。氟化银具有氯化钠型结构,其中的阴离子采用面心立方最密堆积方式,氯化钠的晶胞结构如图所示。则Ag+周围等距离且最近的F−在空间围成的几何构型为

您最近一年使用:0次
2020-09-25更新
|
234次组卷
|
3卷引用:北京市清华大学附属中学中学生标准学术能力基础性测试2021届高三9月测试化学试题
北京市清华大学附属中学中学生标准学术能力基础性测试2021届高三9月测试化学试题(已下线)北京市清华大学附属中学2021届高三上学期9月月考化学试题山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)



