名校
解题方法
1 . 根据已学知识,请回答下列问题:
(1)基态N原子中,核外电子占据的最高能层的符号是_______ ,占据该能层电子的原子轨道形状为_______ 。
(2)写出3p轨道上有2个未成对电子的元素的符号:_______ 。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的价层电子排布式为4s24p4,该元素的名称是_______ 。
(4)已知铁是26号元素,写出基态Fe的价层电子排布式:_______ ;在元素周期表中,该元素在_______ (填“s”“p”“d”“f”或“ds”)区。
(5)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出A1原子的杂化方式_______ ,该阴离子中存在的化学键有_______ (填字母代号)
A.离子键 B.极性键 C.非极性键
D.金属键 E.配位键 F.氢键
(1)基态N原子中,核外电子占据的最高能层的符号是
(2)写出3p轨道上有2个未成对电子的元素的符号:
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的价层电子排布式为4s24p4,该元素的名称是
(4)已知铁是26号元素,写出基态Fe的价层电子排布式:
(5)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出A1原子的杂化方式
A.离子键 B.极性键 C.非极性键
D.金属键 E.配位键 F.氢键
您最近一年使用:0次
2024-04-24更新
|
102次组卷
|
2卷引用:江西省南昌市第十中学2023-2024学年高二下学期第一次月考化学试卷
2 . W、X、Y、Z、M、Q是原子序数依次增大的前四周期元素,其元素性质或原子结构如表所示。
(1)W、Z、Q的元素符号分别为_______ 、_______ 、_______ 。
(2)X的基态原子有_______ 种空间运动状态不同的电子,其中能量最高的电子所占据的原子轨道呈_______ 形。
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有_______ 种。[XW4]+的电子式为_______ 。
(4)M位于元素周期表的_______ 区,M3+简化的电子排布式为_______ 。
(5)Q在元素周期表中的位置为_______ ,其价层电子轨道表达式为_______ 。
(6)基态某原子的价层电子排布式为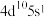 ,推断该元素位于
,推断该元素位于_______ 区。
(7)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成 。
。 与
与 的离子半径大小关系为
的离子半径大小关系为
_______ (填“大于”、“小于”或“等于”) ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是_______ 。
(8)下列各组多电子原子的能级能量比较不正确的是_______ (填序号)。
① ②
② ③
③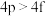 ④
④
| 元素 | 元素性质或原子结构 | ||||||||||||||||||
| W | 电子只有一种自旋取向 | ||||||||||||||||||
| X | 最外层电子排布式为nsnnpn+1 | ||||||||||||||||||
| Y | 非金属元素,且s能级上的电子总数与p能级上的电子总数相等 | ||||||||||||||||||
| Z |
| ||||||||||||||||||
| M | 前四周期元素中原子核外未成对电子数最多 | ||||||||||||||||||
| Q | 基态原子M能层全充满,N层没有成对电子 | ||||||||||||||||||
(2)X的基态原子有
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有
(4)M位于元素周期表的
(5)Q在元素周期表中的位置为
(6)基态某原子的价层电子排布式为
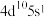 ,推断该元素位于
,推断该元素位于(7)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成
 。
。 与
与 的离子半径大小关系为
的离子半径大小关系为
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是(8)下列各组多电子原子的能级能量比较不正确的是
①
 ②
② ③
③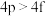 ④
④
您最近一年使用:0次
2024-04-09更新
|
81次组卷
|
2卷引用:江西省南昌市第十九中学2023-2024学年高二上学期期末考试化学试卷
名校
解题方法
3 . 硅元素广泛应用于半导体、光伏、塑料工业。回答下列问题:
(1)同周期元素中,成对电子数比硅多的元素有___________ 种。
(2)晶体硅和碳化硅的熔点相比,较高的是________ (填化学式),原因是_______ 。
(3)由于硅的价层有d轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物 (平面形)和
(平面形)和 中,更易形成配合物的是
中,更易形成配合物的是_______ (填化学式);下列划线原子与 中N原子杂化类型相同的是
中N原子杂化类型相同的是_________ (填序号)。
A.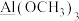 B.
B. C.
C.
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为120°,z方向垂直于x、y方向,底面棱长均为a ,侧面棱长为c
,侧面棱长为c ),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。
),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。

① 原子构成正四面体,则A原子的分数坐标为
原子构成正四面体,则A原子的分数坐标为___________ 。
②该新型材料的化学式为___________ ,已知该新型材料的摩尔质量为M ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则密度为
表示,则密度为___________  (用含a、c、M、
(用含a、c、M、 的计算式表示)。
的计算式表示)。
(1)同周期元素中,成对电子数比硅多的元素有
(2)晶体硅和碳化硅的熔点相比,较高的是
(3)由于硅的价层有d轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物
 (平面形)和
(平面形)和 中,更易形成配合物的是
中,更易形成配合物的是 中N原子杂化类型相同的是
中N原子杂化类型相同的是A.
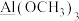 B.
B. C.
C.
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为120°,z方向垂直于x、y方向,底面棱长均为a
 ,侧面棱长为c
,侧面棱长为c ),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。
),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。
①
 原子构成正四面体,则A原子的分数坐标为
原子构成正四面体,则A原子的分数坐标为②该新型材料的化学式为
 ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则密度为
表示,则密度为 (用含a、c、M、
(用含a、c、M、 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
名校
4 . 我国科研工作者开发了质子陶瓷燃料电池的高活性 阴极,使用这种核/双壳LSNM阴极的电池具有良好耐久性的优异性能。请回答下列问题:
阴极,使用这种核/双壳LSNM阴极的电池具有良好耐久性的优异性能。请回答下列问题:
(1)已知La的价层电子排布式为 ,则其在元素周期表的位置为第
,则其在元素周期表的位置为第___________ 周期第___________ 族,基态Mn原子的未成对电子数为___________ 。
(2)一种Mn的配合物如图所示。

①该配合物中涉及的元素C、N、O、F的第一电离能由大到小的顺序为___________ (写元素符号),分子中C原子与F原子形成的化学键为___________ (填轨道重叠方式) 键。
键。
②该配合物中,提供孤对电子的是___________ (写元素符号),Mn(Ⅲ)的配位数为___________ 。
(3)一种镧镍储氢合金 的六方晶胞结构如图所示。
的六方晶胞结构如图所示。

①镧镍储氢合金的化学式为___________ 。
②设晶胞底面积为 ,高为
,高为 ,
, 为阿伏加德罗常数的值,该晶体密度为
为阿伏加德罗常数的值,该晶体密度为___________  。
。
 阴极,使用这种核/双壳LSNM阴极的电池具有良好耐久性的优异性能。请回答下列问题:
阴极,使用这种核/双壳LSNM阴极的电池具有良好耐久性的优异性能。请回答下列问题:(1)已知La的价层电子排布式为
 ,则其在元素周期表的位置为第
,则其在元素周期表的位置为第(2)一种Mn的配合物如图所示。

①该配合物中涉及的元素C、N、O、F的第一电离能由大到小的顺序为
 键。
键。②该配合物中,提供孤对电子的是
(3)一种镧镍储氢合金
 的六方晶胞结构如图所示。
的六方晶胞结构如图所示。
①镧镍储氢合金的化学式为
②设晶胞底面积为
 ,高为
,高为 ,
, 为阿伏加德罗常数的值,该晶体密度为
为阿伏加德罗常数的值,该晶体密度为 。
。
您最近一年使用:0次
名校
解题方法
5 . B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)基态Co原子核外电子占据_______ 种不同的能级,其中有_______ 个未成对电子。
(2)Co能形成 。
。
①1mol该离子中含有σ键的数目为_______ 。
②相同压强下,CO晶体的熔点高于 晶体的原因是
晶体的原因是_______ 。
(3)氟硼酸铵( )用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等。是合成氮化硼纳米管的原料之一。
)用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等。是合成氮化硼纳米管的原料之一。
①1mol 含有
含有_______ mol配位键。
②第一电离能大小介于B和N之间的基态原子第一电离能由大到小的顺序为_______ (用元素符号表示)。
③ 的空间立体构型为
的空间立体构型为_______ ,其中硼原子的杂化轨道类型为_______ 。
(1)基态Co原子核外电子占据
(2)Co能形成
 。
。①1mol该离子中含有σ键的数目为
②相同压强下,CO晶体的熔点高于
 晶体的原因是
晶体的原因是(3)氟硼酸铵(
 )用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等。是合成氮化硼纳米管的原料之一。
)用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等。是合成氮化硼纳米管的原料之一。①1mol
 含有
含有②第一电离能大小介于B和N之间的基态原子第一电离能由大到小的顺序为
③
 的空间立体构型为
的空间立体构型为
您最近一年使用:0次
2023-05-18更新
|
259次组卷
|
2卷引用:江西省大余中学2022-2023学年高二下学期6月期末考试化学试题
名校
解题方法
6 . 硒-钴-镧(La)三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:
(1)与钴位于同一周期且含有相同未成对电子数的元素为_______ (填元素符号)。
(2)元素Se、O、N的第一电离能由大到小的顺序为______________ 。

(3)硒的某种氧化物为链状聚合结构(如图所示),该氧化物的化学式为_____ 。SeO3的空间结构为_________ 。

(4)[Co(15—冠—5)(H2O2)2+](“15—冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图所示,该配位离子中含有的σ键数目为_______ 。全惠斯勒合金CrxCoyAlz的晶胞结构如图所示,其化学式为__________ 。

 CrxCoyAlz晶胞结构示意图
CrxCoyAlz晶胞结构示意图
(1)与钴位于同一周期且含有相同未成对电子数的元素为
(2)元素Se、O、N的第一电离能由大到小的顺序为

(3)硒的某种氧化物为链状聚合结构(如图所示),该氧化物的化学式为

(4)[Co(15—冠—5)(H2O2)2+](“15—冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图所示,该配位离子中含有的σ键数目为

 CrxCoyAlz晶胞结构示意图
CrxCoyAlz晶胞结构示意图
您最近一年使用:0次
名校
解题方法
7 . 前四周期元素A、B、C、D、E原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有_______ 种能量不同的电子, 简化的电子排布式为_______ ,D位于元素周期表第_______ 行第_______ 列。
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式_______ 。
(3)A、B、C、D四种元素第一电离能由大到小的顺序为_______ (用元素符号表示)。B、C、D三种元素的简单离子的半径由大到小的顺序为_______ (用离子符号表示)。
(4)A的简单氢化物与最高价氧化物对应的水化物可以发生反应,则生成物中阳离子的结构式为_______ 。
(5)含元素C的物质做焰色反应实验时,焰色呈_______ 色。
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布式为nsn-1npn+1 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
(1)E元素基态原子核外有
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式
(3)A、B、C、D四种元素第一电离能由大到小的顺序为
(4)A的简单氢化物与最高价氧化物对应的水化物可以发生反应,则生成物中阳离子的结构式为
(5)含元素C的物质做焰色反应实验时,焰色呈
您最近一年使用:0次
2022-05-08更新
|
109次组卷
|
2卷引用:江西省宜春市上高中学2022-2023学年高二下学期5月期中化学试题
解题方法
8 . S、Se 、N、Fe等元素及其化合物在科学研究和工业生产中具有重要的作用。
(1)臭鼬排放的臭气主要成分为3﹣MBT,键线式如图所示:

0.1mol 3﹣MBT中含有σ键数目为___________ (NA为阿伏加德罗常数的值)。3﹣MBT的沸点低于(CH3)2C=CHCH2OH,主要原因是___________ 。
(2)2020年12月17日,采撷月壤的嫦娥五号荣耀归来。嫦娥五号探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质。硒为第四周期第VIA族元素,其氧化物有SeO2和SeO3两种,SeO3分子的立体构型为___________ ,与其互为等电子体的阴离子为 ___________ (举一例)。
(3)铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
①K3[Fe(CN)6]中所涉及的各元素的第一电离能由大到小的顺序为___________ 。
②(CN)2分子中存在碳碳键,C原子的杂化轨道类型为___________ 。
③下列选项是部分同学画的基态氮原子的核外电子排布图,其中违背泡利原理的是___________ (填序号,下同),违背洪特规则的是___________ 。
A.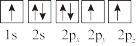 B.
B. 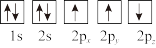 C.
C. 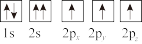
(4)如图是金属铁晶体中的一个晶胞。
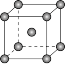
①该晶体中原子总体积占晶体体积的比值为___________ (用含π的最简代数式表示)。
②铁原子的半径为rpm,其晶体密度为___________ g•cm﹣3(用含有r、NA的最简代数式表示)。
(1)臭鼬排放的臭气主要成分为3﹣MBT,键线式如图所示:

0.1mol 3﹣MBT中含有σ键数目为
(2)2020年12月17日,采撷月壤的嫦娥五号荣耀归来。嫦娥五号探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质。硒为第四周期第VIA族元素,其氧化物有SeO2和SeO3两种,SeO3分子的立体构型为
(3)铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
①K3[Fe(CN)6]中所涉及的各元素的第一电离能由大到小的顺序为
②(CN)2分子中存在碳碳键,C原子的杂化轨道类型为
③下列选项是部分同学画的基态氮原子的核外电子排布图,其中违背泡利原理的是
A.
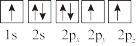 B.
B. 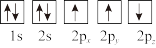 C.
C. 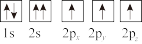
(4)如图是金属铁晶体中的一个晶胞。

①该晶体中原子总体积占晶体体积的比值为
②铁原子的半径为rpm,其晶体密度为
您最近一年使用:0次
名校
9 . 据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成碳的含氧衍生物。
请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,基态原子核外电子排布要遵循“洪特规则特例”,该原子的外围电子排布式为_________ 。在3d过渡金属中,基态原子未成对电子数最多的元素是_________ (填元素符号)。
(2)石墨烯限域单原子铁能活化CH4分子中C—H键,导致C—H键的键能_________ (填“增大”“减小”或“不变” )。铁晶体中粒子之间作用力类型是_________ 。
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_________ 。
②CH4、HCHO的键角较大的是_________ ,主要原因是_________ 。
(4)钴晶胞、白铜(铜镍合金)晶胞如图所示。
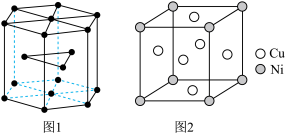
①钴晶胞堆积方式的名称为_________ 。
②已知白铜晶胞的密度为d g·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_________ pm(只列出计算式)。
请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,基态原子核外电子排布要遵循“洪特规则特例”,该原子的外围电子排布式为
(2)石墨烯限域单原子铁能活化CH4分子中C—H键,导致C—H键的键能
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是
②CH4、HCHO的键角较大的是
(4)钴晶胞、白铜(铜镍合金)晶胞如图所示。

①钴晶胞堆积方式的名称为
②已知白铜晶胞的密度为d g·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为
您最近一年使用:0次
2020-12-24更新
|
340次组卷
|
3卷引用:江西省宜春市2021届高三4月模拟考试理科综合化学试题
解题方法
10 . 离子液体是种由离子组成的液体,因其具有许多独特的性质而成为当前科学研究的热点之一, 是一种离子液体(记为X)。
是一种离子液体(记为X)。
(1)基态氮原子的最高能级电子排布图为__________ ,[FeCl4]-中铁的M能层中电子运动状态有_________ 种。
(2)X离子液体中的碳原子杂化轨道类型为___________ ,存在以碳原子为中心的四面体结构有_______ 个,该物质中不存在__________ (填标号)。
A.离子键 B.氢键 C.π键 D.配位键
(3)已知三氯化铁熔点为306℃,易溶解在甲醇、乙醇中,三氟化铁熔点高于1000℃,不溶于甲醇、乙醇。三氟化铁熔点远高于三氯化铁的主要原因是_________________________ ,则三氯化铁晶体中结构粒子是_________ (填标号)。
A.Fe3+、Cl- B.Fe、Cl C.FeCl3分子
(4)铁能形成多种氧化物,其中一种的晶胞如图所示:

该氧化物的化学式为___________ ,若O、Fe原子半径分别为a pm、b pm,Fe与O在晶体中紧密接触,若晶体的密度为ρ g·cm-3,则阿伏加 德罗常数NA=__________ mol-1,空间利用率为_______________ (用含圆周率π、a、b的式子表示)。
 是一种离子液体(记为X)。
是一种离子液体(记为X)。(1)基态氮原子的最高能级电子排布图为
(2)X离子液体中的碳原子杂化轨道类型为
A.离子键 B.氢键 C.π键 D.配位键
(3)已知三氯化铁熔点为306℃,易溶解在甲醇、乙醇中,三氟化铁熔点高于1000℃,不溶于甲醇、乙醇。三氟化铁熔点远高于三氯化铁的主要原因是
A.Fe3+、Cl- B.Fe、Cl C.FeCl3分子
(4)铁能形成多种氧化物,其中一种的晶胞如图所示:

该氧化物的化学式为
您最近一年使用:0次



