1 . 如图是人体含量较多元素的质量分数图,下列有关这些元素的说法不正确的是
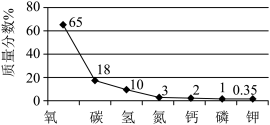
| A.原子半径:N<P |
| B.第一电离能:K>Ca |
C.基态O原子的价层电子轨道表示式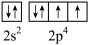 |
| D.图中的七种元素中有2种元素位于周期表第4周期 |
您最近一年使用:0次
2023-03-30更新
|
496次组卷
|
4卷引用:广东省广州市真光中学2022-2023学年高二下学期期中考试化学试题
解题方法
2 . 工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:
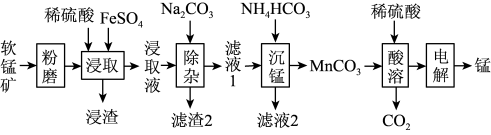
(1)锰元素基态原子的价层电子轨道表示式为_______ 。
(2)经检测“浸取液”中无Fe2+,写出“沉锰”操作中发生反应的离子方程式:_______ 。
(3)为充分利用“滤渣1”,需测定滤渣中铝元素的含量,设计以下方案。
①将ag滤渣处理成V mL溶液。
②取少量①中溶液用EDTA滴定测得溶液中Fe3+ 、Al3+ 的浓度之和为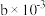 mol·L-1。
mol·L-1。
③另取少量①中溶液将Fe3+ 用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)还原为Fe2+,离子方程式为_______ ;
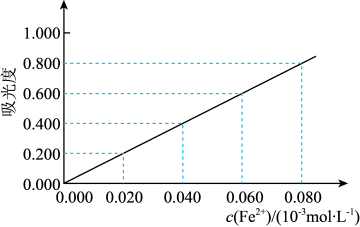
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如图所示)。该样品中铝元素的质量分数为_______ (用含字母的表达式表示)。

(1)锰元素基态原子的价层电子轨道表示式为
(2)经检测“浸取液”中无Fe2+,写出“沉锰”操作中发生反应的离子方程式:
(3)为充分利用“滤渣1”,需测定滤渣中铝元素的含量,设计以下方案。
①将ag滤渣处理成V mL溶液。
②取少量①中溶液用EDTA滴定测得溶液中Fe3+ 、Al3+ 的浓度之和为
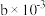 mol·L-1。
mol·L-1。③另取少量①中溶液将Fe3+ 用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)还原为Fe2+,离子方程式为
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如图所示)。该样品中铝元素的质量分数为

您最近一年使用:0次
名校
解题方法
3 . A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的VIB族,F元素的基态原子中有4个未成对电子。
(1)A元素单质的结构式为_______ ,基态E元素原子价层电子排布图为_______ 。
(2)A的氢化物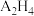 分子属于
分子属于_______ 分子(填“极性或非极性”),A与B形成的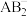 的空间构型为
的空间构型为_______ 。
(3)火箭推动剂由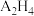 和
和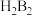 组成,加热反应时有
组成,加热反应时有 元素的单质生成,写出该化学反应方程式:
元素的单质生成,写出该化学反应方程式:_______ 。基态 未成对电子数为
未成对电子数为_______ 个。
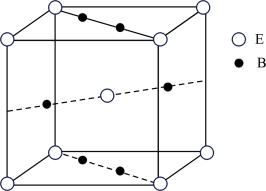
(4)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数(边长)为apm, 为阿伏加德罗常数的值,则该晶胞的密度为
为阿伏加德罗常数的值,则该晶胞的密度为_______  。
。
(1)A元素单质的结构式为
(2)A的氢化物
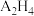 分子属于
分子属于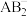 的空间构型为
的空间构型为(3)火箭推动剂由
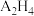 和
和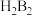 组成,加热反应时有
组成,加热反应时有 元素的单质生成,写出该化学反应方程式:
元素的单质生成,写出该化学反应方程式: 未成对电子数为
未成对电子数为(4)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数(边长)为apm,
 为阿伏加德罗常数的值,则该晶胞的密度为
为阿伏加德罗常数的值,则该晶胞的密度为 。
。
您最近一年使用:0次
解题方法
4 . 阅读材料,根据所学知识回答问题:
2022年6月17日,我国第三艘航空母舰命名为“中国人民解放军海军福建舰”,舷号为“18”。航母的甲板用钢具有高强度、大板面、拒磁、高韧性、抗低温(零下38℃)等特性,铁中掺入铬,铬含量在10.5%以上,它的耐腐蚀性能显著增加,是制装甲的好材料。福建舰采用了目前世界上最先进的电磁弹射技术,使中国海军实力大幅提升,改变了亚太地区的军事力量对比。镍等金属因其优良的电磁性质,故而在航母上广泛应用。
(1)基态铬原子的价电子排布图 为_____ ,量子力学上把电子在原子核外的一个空间运动状态称为一个原子轨道,基态铁原子核外有_____ 种空间运动状态的电子。
(2)下列状态的铁中,是基态亚铁离子的为_____ (填编号)。
(3)Cr3+的一种配合物结构如图,配合物中Cr3+的配位原子为_____ ,配位数为_____ 。

(4)铁及其化合物的晶体种类较多。Fe的一种晶体结构如甲、乙(乙由八个甲堆积而成)所示,若按甲中虚线方向切乙,得到的切面图正确的是_____ (填字母)。

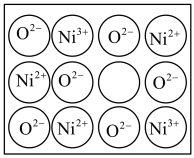
(5)晶体普遍存在各种缺陷。某种NiO晶体中存在如图所示的缺陷:当一个Ni2+空缺,会有两个Ni2+被两个Ni3+所取代,但晶体仍呈电中性。经测定某氧化镍样品的化学式为Ni0.96O,则该样品中Ni3+与Ni2+的离子数之比为_____ 。
2022年6月17日,我国第三艘航空母舰命名为“中国人民解放军海军福建舰”,舷号为“18”。航母的甲板用钢具有高强度、大板面、拒磁、高韧性、抗低温(零下38℃)等特性,铁中掺入铬,铬含量在10.5%以上,它的耐腐蚀性能显著增加,是制装甲的好材料。福建舰采用了目前世界上最先进的电磁弹射技术,使中国海军实力大幅提升,改变了亚太地区的军事力量对比。镍等金属因其优良的电磁性质,故而在航母上广泛应用。
(1)基态铬原子的
(2)下列状态的铁中,是基态亚铁离子的为
A.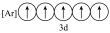 | B.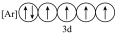 | C.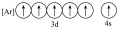 | D.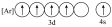 |
(3)Cr3+的一种配合物结构如图,配合物中Cr3+的配位原子为

(4)铁及其化合物的晶体种类较多。Fe的一种晶体结构如甲、乙(乙由八个甲堆积而成)所示,若按甲中虚线方向切乙,得到的切面图正确的是

A. | B.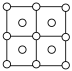 | C.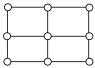 | D.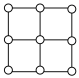 |
(5)晶体普遍存在各种缺陷。某种NiO晶体中存在如图所示的缺陷:当一个Ni2+空缺,会有两个Ni2+被两个Ni3+所取代,但晶体仍呈电中性。经测定某氧化镍样品的化学式为Ni0.96O,则该样品中Ni3+与Ni2+的离子数之比为

您最近一年使用:0次
名校
5 . 碳酸锶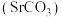 常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量
常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量 、
、 、
、 、
、 等)制备高纯碳酸锶的工艺流程如下:
等)制备高纯碳酸锶的工艺流程如下:

已知:I. 为两性氢氧化物;
为两性氢氧化物;
Ⅱ.常温下,各物质的完全沉淀的 值如下表所示。
值如下表所示。
回答下列问题:
(1)气体 的化学式为
的化学式为____________ ;基态 原子的价层电子排布图为
原子的价层电子排布图为____________ 。
(2)酸溶时为了加快酸容速率,可适当升高温度,但升温度又不能过高的原因是__________________ 。
(3)“系列操作”是煮沸并趁热过滤、____________ 。
(4)用氨水和 分步调节
分步调节 ,而不是直接调节溶液的
,而不是直接调节溶液的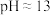 的原因为
的原因为__________________ 。
(5)“调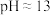 ”后,需对溶液进行煮沸并趁热过滤出“滤渣2”、“滤渣2”的主要成分为
”后,需对溶液进行煮沸并趁热过滤出“滤渣2”、“滤渣2”的主要成分为____________ 、____________ (填化学式);要煮沸并趁热过滤的目的是__________________ 。
(6)“还原”时, (弱酸)与含
(弱酸)与含 微粒发生反应的离子方程式为
微粒发生反应的离子方程式为__________________ 。
(7)“碳化”时,发生反应: ,实际所用
,实际所用 的量为理论用量的111%,若要提纯
的量为理论用量的111%,若要提纯 含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
______  (保留到小数点后两位)。
(保留到小数点后两位)。
 常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量
常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量 、
、 、
、 、
、 等)制备高纯碳酸锶的工艺流程如下:
等)制备高纯碳酸锶的工艺流程如下:
已知:I.
 为两性氢氧化物;
为两性氢氧化物;Ⅱ.常温下,各物质的完全沉淀的
 值如下表所示。
值如下表所示。化合物 |
|
|
|
完全沉淀 | 6.8 | 11.4 | 12.4 |
(1)气体
 的化学式为
的化学式为 原子的价层电子排布图为
原子的价层电子排布图为(2)酸溶时为了加快酸容速率,可适当升高温度,但升温度又不能过高的原因是
(3)“系列操作”是煮沸并趁热过滤、
(4)用氨水和
 分步调节
分步调节 ,而不是直接调节溶液的
,而不是直接调节溶液的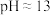 的原因为
的原因为(5)“调
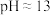 ”后,需对溶液进行煮沸并趁热过滤出“滤渣2”、“滤渣2”的主要成分为
”后,需对溶液进行煮沸并趁热过滤出“滤渣2”、“滤渣2”的主要成分为(6)“还原”时,
 (弱酸)与含
(弱酸)与含 微粒发生反应的离子方程式为
微粒发生反应的离子方程式为(7)“碳化”时,发生反应:
 ,实际所用
,实际所用 的量为理论用量的111%,若要提纯
的量为理论用量的111%,若要提纯 含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
 (保留到小数点后两位)。
(保留到小数点后两位)。
您最近一年使用:0次
6 . A、B、C、D、E、F是元素周期表前四周期中的常见元素,其原子序数依次增大。A元素的一种核素的质量数是14,中子数是8;B元素基态原子的最外层有3个未成对电子,次外层有2个电子;C是地壳中含量最多的一种元素;D元素基态原子核外9个原子轨道上填充了电子且有1个未成对电子;E是一种常见的金属元素,可形成多种氧化物,其中一种氧化物是具有磁性的黑色物质;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。请完成以下空白:
(1)D元素的基态原子中,核外电子占据的最高能层的符号为___________ 。
(2)B元素的基态原子价层电子排布图为___________ 。
(3)请解释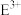 离子比
离子比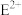 离子稳定的原因
离子稳定的原因___________ 。
(4)基态F二价阳离子的核外电子排布式为___________ 。
(5)A、B、C三种元素的第一电离能从大到小为___________ (用元素符号表示)。
(1)D元素的基态原子中,核外电子占据的最高能层的符号为
(2)B元素的基态原子价层电子排布图为
(3)请解释
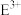 离子比
离子比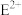 离子稳定的原因
离子稳定的原因(4)基态F二价阳离子的核外电子排布式为
(5)A、B、C三种元素的第一电离能从大到小为
您最近一年使用:0次
7 . 有A、B、C、D、E、F、G七种元素,它们的原子序数依次增大。其中A、B、C、D、E 、F为短周期主族元素, G为第四周期元素。请回答问题。
(1)F是___________ ,D是___________ (填元素符号)。
(2)B基态原子中能量最高的电子,原子轨道呈___________ 形。
(3)比较键长:A-C___________ A-B (填“>”、“=”或“<”)
(4)G3+ 离子电子排布式为___________ 。
(5)某同学根据上述信息,推断D基态原子的核外电子排布图为,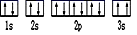 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了___________ 。
(6)金属铜和B的最高价氧化物的水化物的稀溶液可以反应,反应的离子方程式为:___________ 。
| A是宇宙中最丰富的元素,其电子数和电子层数相等 |
| B原子的核外p电子数比s电子数少1 |
| C基态原子L层无空轨道,且成对电子与不成对电子占据的轨道数相等 |
| D原子的第一至第四电离能分别是:I1=730 kJ/mol、I2 = 1455 kJ/mol、I3 = 8633 kJ/mol、I4= 11580 kJ/mol |
| E常温常压下,单质是淡黄色固体,常在火山口附近沉积 |
| F电负性比E大,其单质的水溶液具有漂白性 |
| G在周期表的第八列,是地壳中含量第二位的金属 |
(2)B基态原子中能量最高的电子,原子轨道呈
(3)比较键长:A-C
(4)G3+ 离子电子排布式为
(5)某同学根据上述信息,推断D基态原子的核外电子排布图为,
 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了(6)金属铜和B的最高价氧化物的水化物的稀溶液可以反应,反应的离子方程式为:
您最近一年使用:0次
名校
解题方法
8 . A、B、C、D、E为5种原子序数依次增大的前36号元素,其性质或结构信息如下表。
回答下列问题:
(1)B元素基态原子中能量最高的电子,其电子云在空间有_______ 个伸展方向,其能级符号为_______ 。
(2)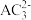 的空间结构为
的空间结构为_______ 。
(3)D元素基态原子的简化电子排布式为_______ 。
(4)元素E位于元素周期表的_______ 区,其基态原子价层电子的轨道表示式为_______ 。
| 元素 | 性质或结构信息 |
| A | 该元素形成的化合物种类最多 |
| B | 元素基态原子核外有7种不同运动状态的电子 |
| C | 地壳中元素含量最高的元素 |
| D | 前四周期中,未成对电子数最多的元素 |
| E | 位于元素周期表第8列 |
回答下列问题:
(1)B元素基态原子中能量最高的电子,其电子云在空间有
(2)
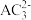 的空间结构为
的空间结构为(3)D元素基态原子的简化电子排布式为
(4)元素E位于元素周期表的
您最近一年使用:0次
解题方法
9 . 请回答下列有关问题。
(1)Fe元素按周期表分区属于_______ 区元素
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是_______ 。
(3)钠在火焰上灼烧产生的黄光是一种_______ (填字母)
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是_______ 。
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是_______ 。
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为_______
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_______ 。
(8)H2O分子的空间构型为_______ 其中心原子的杂化类型_______ 。
(1)Fe元素按周期表分区属于
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是
(3)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(8)H2O分子的空间构型为
您最近一年使用:0次
名校
解题方法
10 . 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态S原子价层电子的电子排布图(轨道表达式)为_______ ,其电子占据最高能级的电子云轮廓图为_______ 形。
(2)根据价层电子对互斥理论, 、
、 、
、 的气态分子中,中心原子价层电子对数不同其他分子的是
的气态分子中,中心原子价层电子对数不同其他分子的是_______ 。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为_______ 形;固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的杂化轨道类型为_______ 。
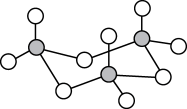
(4)已知亚硫酸根的键角小于硫酸根的键角,请用相关理论解释原因:_______ 。
(5)已知含量酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸: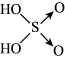 ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。
)。已知亚磷酸(H3PO3)是一种二元中强酸。
①请写出亚磷酸的结构式_______ 。
② 与过量的
与过量的 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
| H2S | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态S原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,
 、
、 、
、 的气态分子中,中心原子价层电子对数不同其他分子的是
的气态分子中,中心原子价层电子对数不同其他分子的是(3)气态三氧化硫以单分子形式存在,其分子的立体构型为

(4)已知亚硫酸根的键角小于硫酸根的键角,请用相关理论解释原因:
(5)已知含量酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸:
 ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。
)。已知亚磷酸(H3PO3)是一种二元中强酸。①请写出亚磷酸的结构式
②
 与过量的
与过量的 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次





