名校
1 . 按要求回答下列问题
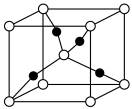
(1) 的晶胞形状为立方体,如图所示。
的晶胞形状为立方体,如图所示。___________ 。
②该晶胞中,每个Ca周围与它最近且相等距离的O有___________ 个。
③该晶胞结构的另一种表示中,Ti处于各顶角位置,则O处于___________ 位置。
(2)镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺,查得:
① 的熔点高于
的熔点高于 ,却远低于
,却远低于 ,原因是
,原因是___________ 。
②镓,锗元素及其化合物有许多用途。比较 ,
, 的键角:Cl-Ga-Cl
的键角:Cl-Ga-Cl___________ Cl-Ge-Cl(填“>”“<”或“=”)
(3) 晶体的晶胞结构如图,晶胞参数为anm,
晶体的晶胞结构如图,晶胞参数为anm, 的配位数
的配位数___________ 。该晶体密度的计算表达式为
___________  。
。
(1)
 的晶胞形状为立方体,如图所示。
的晶胞形状为立方体,如图所示。
②该晶胞中,每个Ca周围与它最近且相等距离的O有
③该晶胞结构的另一种表示中,Ti处于各顶角位置,则O处于
(2)镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺,查得:
| 物质 |  |  |  |
| 熔点/℃ | 124 | 78 | 1000 |
 的熔点高于
的熔点高于 ,却远低于
,却远低于 ,原因是
,原因是②镓,锗元素及其化合物有许多用途。比较
 ,
, 的键角:Cl-Ga-Cl
的键角:Cl-Ga-Cl(3)
 晶体的晶胞结构如图,晶胞参数为anm,
晶体的晶胞结构如图,晶胞参数为anm, 的配位数
的配位数
 。
。
您最近一年使用:0次
2 . 配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:(已知: 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色)
在溶液中为黄色)
(1)下列反应曾用于检测司机是否酒后驾驶,原理如下:

基态Cr原子外围电子轨道表示式为___________ ;配合物 中与Cr3+形成配位键的原子是
中与Cr3+形成配位键的原子是___________ (填元素符号)。
(2)现有下列实验:___________ ,溶剂X可以是___________ (填名称),继续添加氨水,沉淀溶解的离子方程式为___________ 。
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是___________ 。
(3)下列有关化学实验的“操作→现象→解释”均正确的是___________(填字母)。
 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色)
在溶液中为黄色)(1)下列反应曾用于检测司机是否酒后驾驶,原理如下:

基态Cr原子外围电子轨道表示式为
 中与Cr3+形成配位键的原子是
中与Cr3+形成配位键的原子是(2)现有下列实验:

②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是
(3)下列有关化学实验的“操作→现象→解释”均正确的是___________(填字母)。
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | 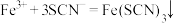 |
| B | 向由0.1mol CrCl3∙6H2O配成的溶液中加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知Cr3+的配位数为6,则CrCl3∙6H2O的化学式可表示为 |
| C | 向K2Cr2O7溶液中先滴加3滴浓硫酸,再改加10滴浓NaOH | 溶液先橙色加深,后变为黄色 | 溶液中存在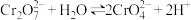 |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 以铁镍合金(含少量铜)为原料,生产电极材粗 的部分工艺流程如下:
的部分工艺流程如下: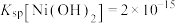 ,
,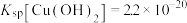 ,
,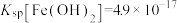 ,
,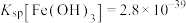 。
。
回答下列问题:
(1)基态Ni原子价层电子轨道表示式是_______ ;Cu原子位于周期表中_______ 区。
(2)“酸溶”时Ni转化为 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是_______ 。
(3)“氧化”时 的作用是(用离子方程式表示)
的作用是(用离子方程式表示)_______ 。
(4)“除铜”时若选用NaOH溶液,会导致部分 也产生沉淀,当常温时溶液中
也产生沉淀,当常温时溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中
_______ 。
(5)“沉镍”时得到碳酸镍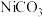 沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式是
,该反应的化学方程式是_______ 。
(6)金属镍的配合物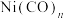 用途广泛,其中配体CO与
用途广泛,其中配体CO与 结构相似,CO分子内σ键与π键个数之比为
结构相似,CO分子内σ键与π键个数之比为_______ 。
 的部分工艺流程如下:
的部分工艺流程如下:
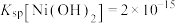 ,
,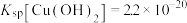 ,
,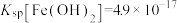 ,
,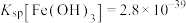 。
。回答下列问题:
(1)基态Ni原子价层电子轨道表示式是
(2)“酸溶”时Ni转化为
 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是(3)“氧化”时
 的作用是(用离子方程式表示)
的作用是(用离子方程式表示)(4)“除铜”时若选用NaOH溶液,会导致部分
 也产生沉淀,当常温时溶液中
也产生沉淀,当常温时溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中
(5)“沉镍”时得到碳酸镍
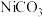 沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式是
,该反应的化学方程式是(6)金属镍的配合物
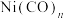 用途广泛,其中配体CO与
用途广泛,其中配体CO与 结构相似,CO分子内σ键与π键个数之比为
结构相似,CO分子内σ键与π键个数之比为
您最近一年使用:0次
2024-04-05更新
|
75次组卷
|
2卷引用:广东省深圳市高级中学2023-2024学年高二下学期期中考试化学试题
4 . 硼及其化合物在新材料、工农业生产等方面用途、广泛。
(1)写出基态B原子的轨道表达式___________ 。
(2)已知:硼酸的电离方程式可表示为H3BO3+H2O⇌[B(OH)4]-+H+。
①根据以上信息,下列说法正确的是_________ 。(填序号)
a.硼酸是一元酸
b.硼酸在电离的过程中,B原子的杂化类型发生了变化
c.硼酸与过量NaOH反应,能观察到白色沉淀逐渐消失
②从化学键的角度表述由H3BO3,形成[B(OH)4]-的过程__________ 。
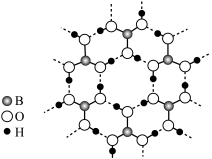
(3)B与N可以形成不同类型的晶体,如六方氮化硼、立方氮化硼等,其结构如图。
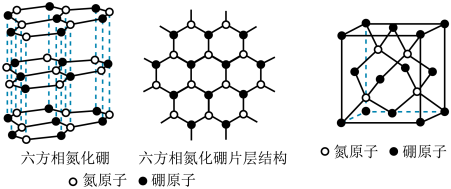
①六方氮化硼的晶体结构类似石墨,每一个B或N的杂化类型是__________ 。
②立方氮化硼因其硬度高、耐磨性好,在机械加工行业广泛用作切削工具。立方氮化硼可在高温高压的条件下由六方氮化硼转化而成。如图,立方氮化硼的晶体类型为___________ ,立方氮化硼的密度为dg⋅cm-3,阿伏加德罗常数为NA,B与N的相对原子质量分别为m和n,则立方晶胞边长a=______________ cm。

(1)写出基态B原子的轨道表达式
(2)已知:硼酸的电离方程式可表示为H3BO3+H2O⇌[B(OH)4]-+H+。
①根据以上信息,下列说法正确的是
a.硼酸是一元酸
b.硼酸在电离的过程中,B原子的杂化类型发生了变化
c.硼酸与过量NaOH反应,能观察到白色沉淀逐渐消失
②从化学键的角度表述由H3BO3,形成[B(OH)4]-的过程
(3)B与N可以形成不同类型的晶体,如六方氮化硼、立方氮化硼等,其结构如图。

①六方氮化硼的晶体结构类似石墨,每一个B或N的杂化类型是
②立方氮化硼因其硬度高、耐磨性好,在机械加工行业广泛用作切削工具。立方氮化硼可在高温高压的条件下由六方氮化硼转化而成。如图,立方氮化硼的晶体类型为
您最近一年使用:0次
解题方法
5 . Ⅰ.磷酸亚铁锂( )可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,以钛铁矿(主要成分为
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,以钛铁矿(主要成分为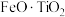 ,还含有MgO、CaO、
,还含有MgO、CaO、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂( )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如下,回答下列问题:
)的工艺流程如下,回答下列问题:

(1)在周期表中,根据对角线规则Li与Mg、Be与Al、B与Si的化学性质相似,写出 与NaOH反应的化学方程式
与NaOH反应的化学方程式_______ 。
(2)元素Fe基态原子的价层电子轨道表示式为_______ 。
(3)①“溶钛”过程反应温度不能太高,其原因是_______ 。
②“煅烧”制备 过程中,
过程中, 和
和 的理论投入量的物质的量之比为
的理论投入量的物质的量之比为_______ 。
Ⅱ.氮的相关化合物在材料等方面有重要用途。回答下列问题:
(4)科学家从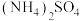 中检出一种组成为
中检出一种组成为 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以 和
和 两种离子的形式存在。
两种离子的形式存在。 的空间构型与
的空间构型与 相同,写出
相同,写出 的结构式
的结构式_______ 。
(5)科学家合成了一种阳离子为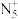 ,其结构是对称的,5个N原子都达到8电子稳定结构,且含有2个氮氮三键,呈V形;此后又合成了一种含有
,其结构是对称的,5个N原子都达到8电子稳定结构,且含有2个氮氮三键,呈V形;此后又合成了一种含有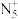 化学式为
化学式为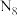 的离子晶体,其阳离子电子式为
的离子晶体,其阳离子电子式为_______ ,阴离子的空间构型为_______ 。
 )可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,以钛铁矿(主要成分为
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,以钛铁矿(主要成分为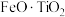 ,还含有MgO、CaO、
,还含有MgO、CaO、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂( )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如下,回答下列问题:
)的工艺流程如下,回答下列问题:
(1)在周期表中,根据对角线规则Li与Mg、Be与Al、B与Si的化学性质相似,写出
 与NaOH反应的化学方程式
与NaOH反应的化学方程式(2)元素Fe基态原子的价层电子轨道表示式为
(3)①“溶钛”过程反应温度不能太高,其原因是
②“煅烧”制备
 过程中,
过程中, 和
和 的理论投入量的物质的量之比为
的理论投入量的物质的量之比为Ⅱ.氮的相关化合物在材料等方面有重要用途。回答下列问题:
(4)科学家从
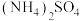 中检出一种组成为
中检出一种组成为 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以 和
和 两种离子的形式存在。
两种离子的形式存在。 的空间构型与
的空间构型与 相同,写出
相同,写出 的结构式
的结构式(5)科学家合成了一种阳离子为
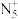 ,其结构是对称的,5个N原子都达到8电子稳定结构,且含有2个氮氮三键,呈V形;此后又合成了一种含有
,其结构是对称的,5个N原子都达到8电子稳定结构,且含有2个氮氮三键,呈V形;此后又合成了一种含有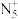 化学式为
化学式为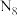 的离子晶体,其阳离子电子式为
的离子晶体,其阳离子电子式为
您最近一年使用:0次
6 . 过渡金属铬、铅、镍、铁及其化合物在工业上有重要用途,回答下列问题:
(1)基态Cr原子的价层电子的轨道表示式为___________ 。
(2)氮化铬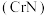 在超级电容器领域具有良好的应用前景,可由
在超级电容器领域具有良好的应用前景,可由 与尿素
与尿素 反应先得到配合物
反应先得到配合物 ,然后在通有
,然后在通有 和
和 混合气体的反应炉内热分解制得。
混合气体的反应炉内热分解制得。
①尿素中C、N、O三种元素的电负性由大到小的顺序为___________ 。
② 中存在的化学键有
中存在的化学键有___________ (填字母)。
A.极性共价键 B.非极性共价键 C.氢键 D.配位键
(3)四卤化硅 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图所示。
的熔点如图所示。 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是___________ 。
②结合 的沸点和
的沸点和 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序, 中的化学键的离子性
中的化学键的离子性___________ (填“增强”“减弱”或“不变”,下同)、共价性___________ 。
(4)丁二酮肟常与 形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
形成图A所示的配合物,图B是图A中硫代氧后的结构简式:___________ 。
(5)某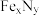 的晶胞如图1所示。Cu可以完全替代该晶胞中a位置Fe或者b位置Fe,形成Cu替代型产物
的晶胞如图1所示。Cu可以完全替代该晶胞中a位置Fe或者b位置Fe,形成Cu替代型产物 。
。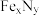 转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为
转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为___________ 。
(1)基态Cr原子的价层电子的轨道表示式为
(2)氮化铬
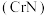 在超级电容器领域具有良好的应用前景,可由
在超级电容器领域具有良好的应用前景,可由 与尿素
与尿素 反应先得到配合物
反应先得到配合物 ,然后在通有
,然后在通有 和
和 混合气体的反应炉内热分解制得。
混合气体的反应炉内热分解制得。①尿素中C、N、O三种元素的电负性由大到小的顺序为
②
 中存在的化学键有
中存在的化学键有A.极性共价键 B.非极性共价键 C.氢键 D.配位键
(3)四卤化硅
 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图所示。
的熔点如图所示。
 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是②结合
 的沸点和
的沸点和 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序, 中的化学键的离子性
中的化学键的离子性(4)丁二酮肟常与
 形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
(5)某
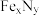 的晶胞如图1所示。Cu可以完全替代该晶胞中a位置Fe或者b位置Fe,形成Cu替代型产物
的晶胞如图1所示。Cu可以完全替代该晶胞中a位置Fe或者b位置Fe,形成Cu替代型产物 。
。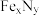 转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为
转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为
您最近一年使用:0次
2023-04-23更新
|
122次组卷
|
2卷引用:安徽省十联盟2022-2023学年高二下学期期中考试化学(B卷)试题
名校
解题方法
7 . 元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子,原子核外有_______ 种不同能量的电子,写出其最外层电子的轨道表示式_______ ;碘元素在元素周期表中的位置是_______ ;液溴的保存通常采取的方法是_______ 。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
(3) 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是_______ 。
(4)已知: 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_______
(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_______
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是_______ (填字母)。
a.海盐提纯:

b.海水提镁:
c.海带提碘: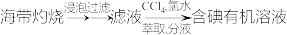

d.海水提溴:
(1)与氯元素同族的短周期元素的原子,原子核外有
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
A. 、 、 、 、 的氧化性 的氧化性 | B. 、 、 、 、 的熔点 的熔点 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是(4)已知:
 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是
a.海盐提纯:


b.海水提镁:

c.海带提碘:
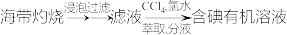

d.海水提溴:

您最近一年使用:0次
2022-11-11更新
|
174次组卷
|
2卷引用:上海市宝山区行知中学2022-2023学年高三上学期期中测试化学试题
名校
解题方法
8 . 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态S原子价层电子的电子排布图(轨道表达式)为_______ ,其电子占据最高能级的电子云轮廓图为_______ 形。
(2)根据价层电子对互斥理论, 、
、 、
、 的气态分子中,中心原子价层电子对数不同其他分子的是
的气态分子中,中心原子价层电子对数不同其他分子的是_______ 。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为_______ 形;固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的杂化轨道类型为_______ 。
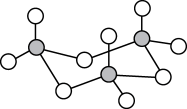
(4)已知亚硫酸根的键角小于硫酸根的键角,请用相关理论解释原因:_______ 。
(5)已知含量酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸: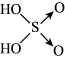 ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。
)。已知亚磷酸(H3PO3)是一种二元中强酸。
①请写出亚磷酸的结构式_______ 。
② 与过量的
与过量的 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
| H2S | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态S原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,
 、
、 、
、 的气态分子中,中心原子价层电子对数不同其他分子的是
的气态分子中,中心原子价层电子对数不同其他分子的是(3)气态三氧化硫以单分子形式存在,其分子的立体构型为

(4)已知亚硫酸根的键角小于硫酸根的键角,请用相关理论解释原因:
(5)已知含量酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸:
 ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。
)。已知亚磷酸(H3PO3)是一种二元中强酸。①请写出亚磷酸的结构式
②
 与过量的
与过量的 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
解题方法
9 . 许多元素及它们的化合物在科学研究和工业生产中具有许多用途,请回答下列有关问题:
(1)某同学画出基态碳原子的核外电子排布图: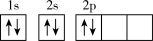 ,该电子排布图违背了
,该电子排布图违背了_______ ;CH 、-CH3、CH
、-CH3、CH 都是重要的有机反应中间体,CH
都是重要的有机反应中间体,CH 的VSEPR模型为
的VSEPR模型为_______ 。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为___________ 。
(3)基态溴原子的价层电子排布图为________ ,用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角___________ 120°(填“>”、“<”或“=”)。
(4)CN-能与多种金属离子形成配合物,例如,工业冶炼金的原理:2[Zn(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有___________ (只写一种),1mol[Zn(CN)4]2-中含_____ molσ键。
(5)类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是___________ 。
(1)某同学画出基态碳原子的核外电子排布图:
 ,该电子排布图违背了
,该电子排布图违背了 、-CH3、CH
、-CH3、CH 都是重要的有机反应中间体,CH
都是重要的有机反应中间体,CH 的VSEPR模型为
的VSEPR模型为(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(3)基态溴原子的价层电子排布图为
(4)CN-能与多种金属离子形成配合物,例如,工业冶炼金的原理:2[Zn(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有
(5)类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是
您最近一年使用:0次
解题方法
10 . 氟及其化合物用途非常广泛。回答下列问题:
(1)基态F原子的价层电子的轨道表达式为____ 。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为_____ ,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_____ 和_____ (各举一例)。
(3)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。 中中心原子的杂化类型是
中中心原子的杂化类型是_____ ;氟化铵中存在的化学键是_____ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键
(4)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为____ kJ·mol-1,S-F键的键能为____ kJ·mol-1。
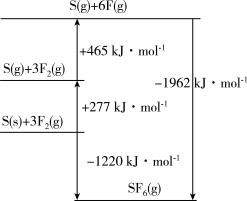
(1)基态F原子的价层电子的轨道表达式为
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为
(3)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。
 中中心原子的杂化类型是
中中心原子的杂化类型是A.离子键 B.σ键 C.π键 D.氢键
(4)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为

您最近一年使用:0次



