名校
解题方法
1 . 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是

A.气态氢化物稳定性: | B.原子半径: |
C.第一电离能: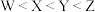 | D.阴、阳离子中均有配位键 |
您最近一年使用:0次
名校
2 . 下列比较正确的是
A.第一电离能: | B.热稳定性: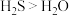 |
C.碱性: | D.电负性: |
您最近一年使用:0次
名校
3 . 研究物质的结构对理解其性质有重要的作用。
(1)原子结构与元素的性质
①四种元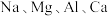 中,第一电离能最大的是
中,第一电离能最大的是_________ 。
②工业上常通过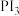 的水解来制备
的水解来制备 和一种磷的含氧酸,该反应的化学方程式为
和一种磷的含氧酸,该反应的化学方程式为______________ ;由该反应可知,电负性P_________ I(填“>”、“<”或“=”)。
③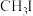 与
与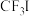 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: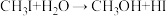 和
和 。
。
结合电负性解释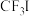 水解生成
水解生成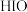 而非
而非 的原因:
的原因:______________ 。
(2)微粒间相互作用与物质性质________ 。
②推测上述氢键的形成_________ (填“增大”或“减小”)了该配合物在水中的溶解性。
(3)有机物的结构与性质
分析以下有机物的结构,回答相应的问题:_________ (填字母);属于苯酚的同系物的是_________ (填字母)。
②c的系统命名是_________ ;f中所含官能团的名称是_________ 。
③写出d与溴水反应的化学方程式:________________ 。
④写出同时满足下列条件的所有e的同分异构体的结构简式:_____________ 。
i.遇 溶液可呈紫色
溶液可呈紫色
ⅱ.苯环上有2种化学环境的氢
(1)原子结构与元素的性质
①四种元
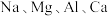 中,第一电离能最大的是
中,第一电离能最大的是②工业上常通过
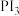 的水解来制备
的水解来制备 和一种磷的含氧酸,该反应的化学方程式为
和一种磷的含氧酸,该反应的化学方程式为③
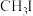 与
与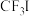 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: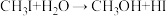 和
和 。
。结合电负性解释
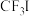 水解生成
水解生成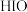 而非
而非 的原因:
的原因:(2)微粒间相互作用与物质性质
丁二酮肟(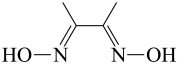 )可选择性地与
)可选择性地与 配位,因而常用于溶液中
配位,因而常用于溶液中 的检验及分离。在丁二酮肟与
的检验及分离。在丁二酮肟与 形成的配合物中,配位原子只有N,通过配位键与氢键可以形成2个五元环和2个六元环。
形成的配合物中,配位原子只有N,通过配位键与氢键可以形成2个五元环和2个六元环。

②推测上述氢键的形成
(3)有机物的结构与性质
分析以下有机物的结构,回答相应的问题:
a. b.
b.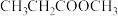 c.
c.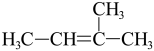
d. e.
e.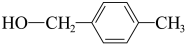 f.
f.
②c的系统命名是
③写出d与溴水反应的化学方程式:
④写出同时满足下列条件的所有e的同分异构体的结构简式:
i.遇
 溶液可呈紫色
溶液可呈紫色ⅱ.苯环上有2种化学环境的氢
您最近一年使用:0次
名校
4 . 下图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是

A.电负性: |
B.离子半径: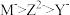 |
C.元素Y、Z、M的第一电离能: |
| D.基态Z原子的未成对电子数是同周期元素的原子中最多的 |
您最近一年使用:0次
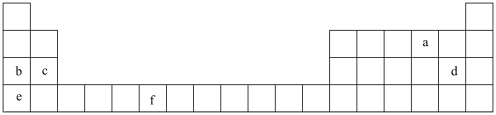
5 . 原子结构、元素性质、元素在周期表中的位置之间存在密切的相互关系。如图是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)a的原子结构示意图为___________ 。
(2)基态b原子核外电子占据的最高能级符号为_______ ,该能级的电子云轮廓图形状为 _______ 形。
(3)元素c位于周期表的_____ 区。
(4)元素b、d、e中电负性最大的是_______ (用元素符号表示)。
(5)基态f原子的价层电子排布式为___________ 。
(6)气态c原子失去核外不同电子所需能量如下:
①元素c的最高化合价为 _______ 。
②c原子的逐级电离能越来越大的原因是__________ 。
(1)a的原子结构示意图为
(2)基态b原子核外电子占据的最高能级符号为
(3)元素c位于周期表的
(4)元素b、d、e中电负性最大的是
(5)基态f原子的价层电子排布式为
(6)气态c原子失去核外不同电子所需能量如下:
| 电离能 | I1(第一电离能) | I2(第二电离能) | I3(第三电离能) |
| 能量/kJ•mol﹣1 | 737.7 | 1450.7 | 7732.7 |
②c原子的逐级电离能越来越大的原因是
您最近一年使用:0次
解题方法
6 . 下列选项中正确的是
| A.第一电离能:I(B)>I(Al) |
| B.原子半径:N<O |
| C.离子半径:r(K+)>r(Cl﹣) |
| D.键长:H﹣Cl>H﹣Br |
您最近一年使用:0次
7 . 金属铑(45Rh)的磷化物Rh2P可用作电解水的高效催化剂,其晶胞如图所示。已知晶胞为立方体,边长为acm,下列说法不正确的是

| A.Rh在周期表中第5周期,Ⅷ族,是d区元素 |
| B.P的第一电离能比硫元素的大,电负性比硫元素的小 |
C.Rh2P晶体的密度为 g·cm-3 g·cm-3 |
| D.在Rh2P晶体中,P的配位数为4 |
您最近一年使用:0次
解题方法
8 . 三磷酸腺苷(ATP)是生物体的供能物质,由腺苷(A)与磷酸反应而成。_____ 。
(2)ATP比A更易溶于水,从微粒间相互作用的角度解释其原因:_____ 。
(3)ATP的碱基中,碳原子的杂化方式为_____ 。
(4)ATP中的碱基与尿嘧啶作用时,形成的氢键的种类可能有_____ 。(用“X—H…Y”表示)。_____ 。
②PO 是一种配体。PO
是一种配体。PO 配位时配位原子是
配位时配位原子是_____ ,理由是_____ 。

(2)ATP比A更易溶于水,从微粒间相互作用的角度解释其原因:
(3)ATP的碱基中,碳原子的杂化方式为
(4)ATP中的碱基与尿嘧啶作用时,形成的氢键的种类可能有


②PO
 是一种配体。PO
是一种配体。PO 配位时配位原子是
配位时配位原子是
您最近一年使用:0次
2024-04-13更新
|
447次组卷
|
3卷引用:北京市海淀区2023-2024学年高三下学期期中练习化学试题
名校
9 . NH3具有易液化、含氢密度高、应用广泛等优点,NH3的合成及应用一直是科学研究的重要课题。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为_____ 。
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是_____ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_____ 。
②NaHCO3分解得Na2CO3., 空间结构为
空间结构为_____ 。
(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
①NH3的中心原子的杂化轨道类型为_____ 。
②比较熔点:NH3BH3_____ CH3CH3(填“>”或“<”)。
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为_____ 。
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是_____ 。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3.,
 空间结构为
空间结构为(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
| 元素 | H | B | N | F |
| 电负性 | 2.1 | 2.0 | 3.0 | 4.0 |
②比较熔点:NH3BH3
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是
您最近一年使用:0次
2024-03-03更新
|
281次组卷
|
2卷引用:北京市第十九中学2021-2022学年高二下学期期中考试化学试题
10 . 某元素X的第一电离能至第五电离能大小如图所示,下列说法正确的是
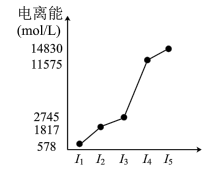
| A.X元素的化合价为+4价 |
| B.X是非金属元素 |
| C.X为第五周期元素 |
| D.X与氯气反应时化合价可能变为+3价 |
您最近一年使用:0次
2024-03-03更新
|
331次组卷
|
5卷引用:北京市第十九中学2021-2022学年高二下学期期中考试化学试题



