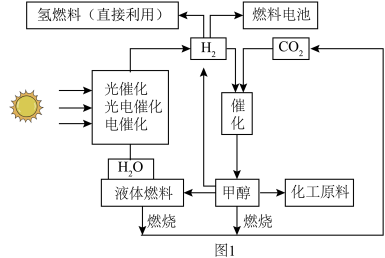
1 . “液态阳光”是指利用太阳能等可再生能源产生的电力电解水生产“绿色”氢能,再和从空气中捕获的二氧化碳通过催化过程转化为甲醇等液体燃料。甲醇可以直接作为能源,也可以作为化工原料。图1是“液态阳光”的合成技术线路示意图。___________ 。
A.石油 B.煤 C.风能
(2)与CH3OH互为同系物的是___________。
(3)CH3OH的下列性质与氢键无关的是___________。
(4)利用晶体X射线衍射技术不能测定CH3OH晶体的___________。
(5)下列关于CO2的说法错误的是___________。
(6)太阳能转化为电能时,要用到Si、GaP、GaAs等半导体材料,Ga元素与As同周期,与Al同主族。下列说法正确的是___________。
(7)某同学用图2所示装置(省略夹持装置)自制简单的氢氧燃料电池。___________ 。
A.石墨棒B为阳极 B.此过程中化学能转化为电能
C.石墨棒A的电极反应:2H++2e−=H2↑ D.石墨棒A和B产生等体积的气体
②通电一段时间后,断开K1,闭合K2,发光二极管立即发光。写出正极的电极反应式___________ 。
(8)已知H2(g)和CH3OH(l)的燃烧热分别为﹣286kJ·mol−1和﹣727kJ·mol−1.CO2和H2通过下列反应制备甲醇:CO2(g)+3H2(g) CH3OH(l)+H2O(l),该反应的ΔH=
CH3OH(l)+H2O(l),该反应的ΔH=___________ 。
A.石油 B.煤 C.风能
(2)与CH3OH互为同系物的是___________。
A.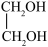 | B.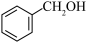 | C. | D.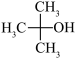 |
(3)CH3OH的下列性质与氢键无关的是___________。
| A.极易溶于水 | B.沸点比CH3SH高 | C.易燃烧 | D.具有还原性 |
(4)利用晶体X射线衍射技术不能测定CH3OH晶体的___________。
| A.化学键的键长 | B.化学键的键能 |
| C.化学键的键角 | D.分子在晶胞中的实际排列情况 |
(5)下列关于CO2的说法错误的是___________。
| A.所有原子共平面 | B.碳原子采取sp2杂化 |
| C.碳原子有2对价层电子对 | D.干冰易升华,可用作人工降雨 |
(6)太阳能转化为电能时,要用到Si、GaP、GaAs等半导体材料,Ga元素与As同周期,与Al同主族。下列说法正确的是___________。
| A.第一电离能:I1(Si)<I1(P) | B.原子半径:r(As)>r(Ga) |
| C.热稳定性:AsH3>PH3 | D.酸性:H2SiO3>H3PO4 |
(7)某同学用图2所示装置(省略夹持装置)自制简单的氢氧燃料电池。

A.石墨棒B为阳极 B.此过程中化学能转化为电能
C.石墨棒A的电极反应:2H++2e−=H2↑ D.石墨棒A和B产生等体积的气体
②通电一段时间后,断开K1,闭合K2,发光二极管立即发光。写出正极的电极反应式
(8)已知H2(g)和CH3OH(l)的燃烧热分别为﹣286kJ·mol−1和﹣727kJ·mol−1.CO2和H2通过下列反应制备甲醇:CO2(g)+3H2(g)
 CH3OH(l)+H2O(l),该反应的ΔH=
CH3OH(l)+H2O(l),该反应的ΔH=
您最近一年使用:0次
名校
2 . 如图为1~19号元素第一电离能 。
。 值增大。但个别元素的
值增大。但个别元素的 值出现反常,预测下列关系式中正确的是___________。
值出现反常,预测下列关系式中正确的是___________。
(2)10号元素 的
的 值较大的原因是
值较大的原因是___________ 。
 。
。
 值增大。但个别元素的
值增大。但个别元素的 值出现反常,预测下列关系式中正确的是___________。
值出现反常,预测下列关系式中正确的是___________。A.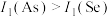 | B.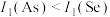 | C.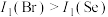 | D. |
(2)10号元素
 的
的 值较大的原因是
值较大的原因是
您最近一年使用:0次
名校
3 . 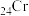 的第二电离能和
的第二电离能和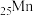 的第二电离能分别为
的第二电离能分别为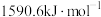 、
、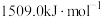 ,
,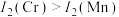 的原因是
的原因是___________ 。
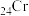 的第二电离能和
的第二电离能和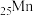 的第二电离能分别为
的第二电离能分别为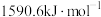 、
、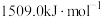 ,
,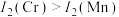 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
4 . 工业上高纯晶体硅时中间产物为SiHCl3,SiHCl3中电负性由大到小的顺序是___________ ,其中处于同一周期的两元素第一电离能大小关系为___________ 。
您最近一年使用:0次
名校
5 . 2021年5月,中国第一辆火星车“祝融号成功登陆火星。探测发现火星上存在大量橄榄石矿物( )。回答下列问题:
)。回答下列问题:
1.基态Fe原子的价电子排布式为___________ 。橄榄石中,铁元素的化合价为___________ ,所含各主族元素电负性由大到小的顺序为___________ 。
2.用一个方程式表示Na与Mg金属性的相对强弱___________ 。
3.基态氧原子的轨道表示式为___________ ,其2p能级的未成对电子具有不同的___________ (填选项)。
A.能量 B.电子云的形状 C.自旋状态 D.电子云的伸展方向
4.已知NaCl熔点为800.7℃, 熔点为-68.8℃,Na与Si均为第三周期元素,NaCl熔点明显高于
熔点为-68.8℃,Na与Si均为第三周期元素,NaCl熔点明显高于 ,原因是
,原因是___________ 。 的空间结构为
的空间结构为___________ ,Si原子的杂化方式是___________ 。
5.由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]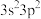 ②[Ne]
②[Ne]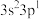 ③[Ne]
③[Ne] ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
6.X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的2s轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法错误的是___________。
 )。回答下列问题:
)。回答下列问题:1.基态Fe原子的价电子排布式为
2.用一个方程式表示Na与Mg金属性的相对强弱
3.基态氧原子的轨道表示式为
A.能量 B.电子云的形状 C.自旋状态 D.电子云的伸展方向
4.已知NaCl熔点为800.7℃,
 熔点为-68.8℃,Na与Si均为第三周期元素,NaCl熔点明显高于
熔点为-68.8℃,Na与Si均为第三周期元素,NaCl熔点明显高于 ,原因是
,原因是 的空间结构为
的空间结构为5.由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]
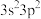 ②[Ne]
②[Ne]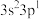 ③[Ne]
③[Ne] ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>②>① | B.电子排布属于基态原子的是:①③ |
| C.电离出一个电子所需能量:②>①>③ | D.得电子能力:①>② |
| A.电负性:Z>X |
| B.最高正价:Z<M |
| C.Q与M的化合物中可能含有非极性共价键 |
| D.最高价氧化物对应水化物的酸性:Z>Y |
您最近一年使用:0次
6 . 将第二周期元素 、
、 、B按第一电离能递减顺序排列:
、B按第一电离能递减顺序排列:___________ >___________ >___________ 。
 、
、 、B按第一电离能递减顺序排列:
、B按第一电离能递减顺序排列:
您最近一年使用:0次
名校
解题方法
7 . 关于 的说法中正确的是
的说法中正确的是
 的说法中正确的是
的说法中正确的是| A.第一电离能:B>F | B. 的空间填充模型: 的空间填充模型: |
C. 为非极性分子 为非极性分子 | D. 中的共价键为非极性键 中的共价键为非极性键 |
您最近一年使用:0次
名校
解题方法
8 . 某储氢材料前驱体结构如下图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法错误的是


| A.简单氢化物沸点高低:X<Y | B.Y和W位于同一主族 |
| C.第一电离能大小:X<Y<Z | D.阴、阳离子中均有配位键 |
您最近一年使用:0次
名校
解题方法
9 . 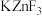 被认为是良好的光学基质材料,可由
被认为是良好的光学基质材料,可由 、
、 、
、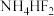 制备。回答下列问题:
制备。回答下列问题:
(1)基态Zn原子的价电子轨道表达式为___________ ;基态N原子中未成对电子数为___________ 。
(2)O的第一电离能小于N的第一电离能的原因是___________ ;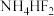 的组成元素中电负性由大到小的顺序为
的组成元素中电负性由大到小的顺序为___________ (用元素符号表示)。
(3) 中阴离子的空间构型为
中阴离子的空间构型为___________ ;其中C原子的杂化方式为___________ 。
(4) 具有金红石型四方结构,
具有金红石型四方结构, 具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
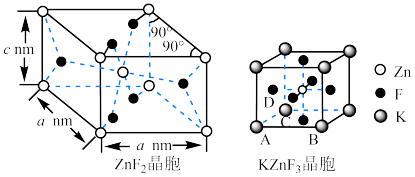
① 和
和 晶体中,Zn的配位数之比为
晶体中,Zn的配位数之比为___________ 。
②若 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为___________  (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
 被认为是良好的光学基质材料,可由
被认为是良好的光学基质材料,可由 、
、 、
、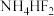 制备。回答下列问题:
制备。回答下列问题:(1)基态Zn原子的价电子轨道表达式为
(2)O的第一电离能小于N的第一电离能的原因是
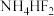 的组成元素中电负性由大到小的顺序为
的组成元素中电负性由大到小的顺序为(3)
 中阴离子的空间构型为
中阴离子的空间构型为(4)
 具有金红石型四方结构,
具有金红石型四方结构,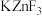 具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
①
 和
和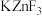 晶体中,Zn的配位数之比为
晶体中,Zn的配位数之比为②若
 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为 (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-01-08更新
|
237次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期期中考试卷(化学)
名校
解题方法
10 . 物质所表现出来的宏观性质,都有相应的微观本质原因。宏观辨识与微观探析是我们认识物质的两个视角。
(1)某反应过程中的能量变化如图所示:

①若加入催化剂,则b___________ (填“增大”、“减小”或“不变”,下同),
___________ 。
②根据图像,该反应 =
=___________ (用含a、b的代数式表示)。
(2)a、b、c、d、e、f、g是元素周期表中原子序数依次增大的前四周期的元素。有关信息如下,请回答以下问题:
①f的元素名称为 ___________ ,位于元素周期表的 ___________ 区。
②e的基态原子中能量最高的电子所占的轨道形状是___________ ,其电子云在空间有 ___________ 个伸展方向。
③a的最高价氧化物的空间结构是___________ 。
④强碱性溶液中d盐将转化为[d(OH)4]-,在如图中标出[d(OH)4]-结构中的配位键。

___________
⑤元素f基态原子的第二电离能___________ 元素g基态原子的第二电离能(填“>”、“<”或“=”),原因是 ___________ 。
(1)某反应过程中的能量变化如图所示:

①若加入催化剂,则b

②根据图像,该反应
 =
=(2)a、b、c、d、e、f、g是元素周期表中原子序数依次增大的前四周期的元素。有关信息如下,请回答以下问题:
| 元素符号 | 元素信息 |
| a | a能形成一种硬度最大的固体单质 |
| b | 在同周期元素中,b的基态原子未成对电子数最多 |
| c | c元素基态原子的电子排布式为1s22s22p4 |
| d | d基态原子的I1=578kJ•mol-1;I2=1817kJ•mol-1;I3=2745kJ•mol-1;I4=11575kJ•mol-1 |
| e | e基态原子核外3p轨道半满 |
| f | f在周期表中第11纵行 |
| g | g基态原子最外层电子数为2 |
②e的基态原子中能量最高的电子所占的轨道形状是
③a的最高价氧化物的空间结构是
④强碱性溶液中d盐将转化为[d(OH)4]-,在如图中标出[d(OH)4]-结构中的配位键。

⑤元素f基态原子的第二电离能
您最近一年使用:0次



