1 . X、Y、Z、W为原子序数依次增大的四种短周期元素,x的核外电子总数与其周期数相同,Y的基态原子的价层电子中有3个未成对电子,乙的最外层电子数为其内层电子数的3倍;Z与W同主族。下列说法正确的是
A.离子半径: | B.键角: |
C.气态氢化物的热稳定性: | D.第一电离能: |
您最近一年使用:0次
解题方法
2 . 下列说法错误的是
A. 的沸点高于 的沸点高于 是因为O的电负性大于S 是因为O的电负性大于S |
B.配离子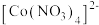 中各元素第一电离能: 中各元素第一电离能: |
C.N与N的π键比P与P的强,可推断 的稳定性比 的稳定性比 的高 的高 |
D. 中 中 的键角大于 的键角大于 中 中 的键角 的键角 |
您最近一年使用:0次
解题方法
3 . 硒是人体必需的14种微量元素之一,5月17日是我国的“全民补硒日”。
(1)试写出Se的价电子排布图_______ 。同周期元素中第一电离能大于Se的有_______ 种。
(2)Se的某些同素异形体由Se8环构成,Se8环中Se-Se-Se平均键角最接近:_______ (填选项序号)。存在一种Se 离子,其呈平面正方形结构,经测定Se
离子,其呈平面正方形结构,经测定Se 离子中的键长短于Se8环,试简述可能原因
离子中的键长短于Se8环,试简述可能原因_______ 。
a. 120° b. 105° c. 112°
(3)Se在形成-2价阴离子时需要吸收大量的热,却很容易形成K2Se等典型的离子化合物,请解释其原因_______ 。
(4)K2Se晶体具有典型的反萤石结构(如图所示) A的分数坐标为(0, 0, 0),B的分数坐标为( ,0,
,0, ),则C点的分数坐标为
),则C点的分数坐标为_______ ;若该K+和Se2-的半径分别是a pm和b pm,该晶胞的密度为_______ g·cm-3(NA表示阿伏加德罗常数的值)。

(1)试写出Se的价电子排布图
(2)Se的某些同素异形体由Se8环构成,Se8环中Se-Se-Se平均键角最接近:
 离子,其呈平面正方形结构,经测定Se
离子,其呈平面正方形结构,经测定Se 离子中的键长短于Se8环,试简述可能原因
离子中的键长短于Se8环,试简述可能原因a. 120° b. 105° c. 112°
(3)Se在形成-2价阴离子时需要吸收大量的热,却很容易形成K2Se等典型的离子化合物,请解释其原因
(4)K2Se晶体具有典型的反萤石结构(如图所示) A的分数坐标为(0, 0, 0),B的分数坐标为(
 ,0,
,0, ),则C点的分数坐标为
),则C点的分数坐标为
您最近一年使用:0次
解题方法
4 . 钛及其化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)Ti(BH4)3是一种储氢材料。BH 的空间构型为
的空间构型为_______ ;Ti 、B、H元素的电负性由大到小排列顺序为_______ 。
(2)已知Ti3+易形成多种配合物,[TiCl( H2O)5]Cl2· H2O是其中的一种。
①1 mol该配合物中含有_______ molσ键。
②中心离子杂化方式为_______ (填标号)。
a.sp2 b.sp3 c.sp3d d.sp3d2
③Ti3+具有较强还原性的原因是_______ 。
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-x Ny,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据_______ 个氧原子围成的八面体空隙。
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为( ,
, ,
, ),则A点原子的分数坐标为
),则A点原子的分数坐标为_______ ;晶胞中A、B间距离为_______ pm;TiO2晶体密度为_______ g·cm-3(设NA为阿伏加德罗常数的值)。
③TiO2-x Ny晶体中x=_______ 。
(1)Ti(BH4)3是一种储氢材料。BH
 的空间构型为
的空间构型为(2)已知Ti3+易形成多种配合物,[TiCl( H2O)5]Cl2· H2O是其中的一种。
①1 mol该配合物中含有
②中心离子杂化方式为
a.sp2 b.sp3 c.sp3d d.sp3d2
③Ti3+具有较强还原性的原因是
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-x Ny,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为(
 ,
, ,
, ),则A点原子的分数坐标为
),则A点原子的分数坐标为③TiO2-x Ny晶体中x=
您最近一年使用:0次
解题方法
5 . 如图化合物是一种常见的储氢材料,其中X、Y、Z为原子序数依次增大的短周期元素,且X、Y、Z分别处于不同周期。下列叙述正确的是
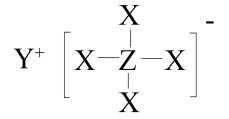
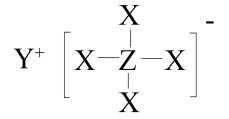
| A.第一电离能:X>Y>Z |
| B.含Z的盐溶液一定显酸性 |
| C.Y与X可形成离子化合物YX |
| D.Y单质在空气中燃烧的产物是Y2O2 |
您最近一年使用:0次
解题方法
6 . 1934年,约里奥·居里夫妇用 粒子(即氦核
粒子(即氦核 )轰击某金属原子
)轰击某金属原子 得到
得到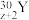 ,具有放射性,可衰变为
,具有放射性,可衰变为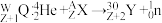 ,
,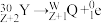 。基态Y原子3p能级半充满。下列说法错误的是
。基态Y原子3p能级半充满。下列说法错误的是
 粒子(即氦核
粒子(即氦核 )轰击某金属原子
)轰击某金属原子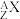 得到
得到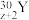 ,具有放射性,可衰变为
,具有放射性,可衰变为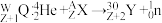 ,
,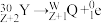 。基态Y原子3p能级半充满。下列说法错误的是
。基态Y原子3p能级半充满。下列说法错误的是| A.X原子核内中子数与质子数之比为14∶13 |
| B.X和Y的氧化物分别为碱性氧化物、酸性氧化物 |
| C.第一电离能:X<Q<Y |
| D.最高价氧化物对应水化物的酸性:Y>Q |
您最近一年使用:0次
解题方法
7 . 硼单质及其化合物在生产生活中应用广泛。
(1)离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物,被认为是21世纪理想的绿色溶剂。氯代 丁基
丁基 甲基咪唑离子液(
甲基咪唑离子液( )可以与
)可以与 发生离子交换反应合成离子液体
发生离子交换反应合成离子液体 ,如下图所示:
,如下图所示:

①第二周期中第一电离能介于B与N之间的元素为___________ (写元素符号); 中N原子的杂化方式为
中N原子的杂化方式为___________ , 的立体构型为
的立体构型为___________ 。
②已知分子或离子中的大 键可以用
键可以用 表示,其中m表示参与形成大
表示,其中m表示参与形成大 键的原子数,n表示大
键的原子数,n表示大 键中的电子数,则
键中的电子数,则 中的大
中的大 键可以表示为
键可以表示为___________ 。
(2)硼酸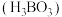 是极弱的一元酸,如图为
是极弱的一元酸,如图为 晶体的片层结构,同一层内硼酸分子间通过
晶体的片层结构,同一层内硼酸分子间通过___________ 相结合,层与层之间通过___________ 相结合。 在热水中比冷水中溶解度显著增大的主要原因是
在热水中比冷水中溶解度显著增大的主要原因是___________ 。

(3)一种新型轻质储氢材料的晶胞结构如图所示:

①该化合物的化学式为___________ 。
②设阿伏加德罗常数的值为 ,则晶胞的密度为
,则晶胞的密度为
___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物,被认为是21世纪理想的绿色溶剂。氯代
 丁基
丁基 甲基咪唑离子液(
甲基咪唑离子液( )可以与
)可以与 发生离子交换反应合成离子液体
发生离子交换反应合成离子液体 ,如下图所示:
,如下图所示:
①第二周期中第一电离能介于B与N之间的元素为
 中N原子的杂化方式为
中N原子的杂化方式为 的立体构型为
的立体构型为②已知分子或离子中的大
 键可以用
键可以用 表示,其中m表示参与形成大
表示,其中m表示参与形成大 键的原子数,n表示大
键的原子数,n表示大 键中的电子数,则
键中的电子数,则 中的大
中的大 键可以表示为
键可以表示为(2)硼酸
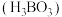 是极弱的一元酸,如图为
是极弱的一元酸,如图为 晶体的片层结构,同一层内硼酸分子间通过
晶体的片层结构,同一层内硼酸分子间通过 在热水中比冷水中溶解度显著增大的主要原因是
在热水中比冷水中溶解度显著增大的主要原因是
(3)一种新型轻质储氢材料的晶胞结构如图所示:

①该化合物的化学式为
②设阿伏加德罗常数的值为
 ,则晶胞的密度为
,则晶胞的密度为
 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2022-05-24更新
|
441次组卷
|
2卷引用:山东省潍坊市2022届高三下学期5月模拟考试(二)化学试题
8 . 碱土金属(IIA族)元素单质及其相关化合物的性质、合成一直以来是化学界研究的重点。回答下列问题:
(1)对于碱土金属元素Be、Mg、Ca、Sr、Ba,随着原子序数的增加,以下性质呈单调递减变化的是____ 。
A.原子半径 B.单质的硬度 C.第一电离能
(2)(NH4)2BeF4是工业制备金属铍过程中的重要中间产物,其阳离子含有的化学键类型为_____ ,阴离子中心原子杂化方式为____ 。
(3)Sr是人体必需的微量元素,SrCO3是其重要的化合物之一。Sr2+的电子排布式为____ 。判断SrCO3的热分解温度____ (填“大于”、“小于”)CaCO3的热分解温度,理由是____ 。
(4)MgH2和金属Ni在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的储氢化合物,其立方晶胞结构如图所示:

①Mg原子周围距离最近且相等的Ni原子有____ 个,若晶胞边长为646pm,则Mg—Ni核间距为____ pm(结果保留小数点后两位,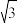 取1.73)。
取1.73)。
②若以晶胞中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则该化合物的储氢能力为____ (列出计算式即可。假定该化合物中所有的H可以全部放出,液氢密度为dg•cm-3;设NA代表阿伏加德罗常数的值)。
(1)对于碱土金属元素Be、Mg、Ca、Sr、Ba,随着原子序数的增加,以下性质呈单调递减变化的是
A.原子半径 B.单质的硬度 C.第一电离能
(2)(NH4)2BeF4是工业制备金属铍过程中的重要中间产物,其阳离子含有的化学键类型为
(3)Sr是人体必需的微量元素,SrCO3是其重要的化合物之一。Sr2+的电子排布式为
(4)MgH2和金属Ni在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的储氢化合物,其立方晶胞结构如图所示:

①Mg原子周围距离最近且相等的Ni原子有
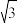 取1.73)。
取1.73)。②若以晶胞中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则该化合物的储氢能力为
您最近一年使用:0次
9 . 短周期主族元素W、X、Y、Z的原子序数依次增大,它们形成的一种化合物的结构如图所示。已知W和X的原子序数之和与Y的最外层电子数相等。下列说法错误的是
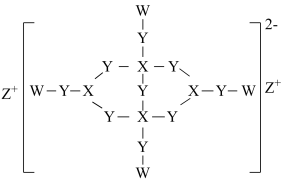

| A.简单离子半径:Y>Z |
| B.该化合物中X的杂化方式相同 |
| C.第一电离能:Y>X |
| D.化合物ZYW中既含离子键,又含极性共价键 |
您最近一年使用:0次
2022-05-20更新
|
298次组卷
|
2卷引用:山东省威海市2022届高三第二次模拟考试化学试题
10 . 短周期主族元素X、Y、Z、M、N的原子序数依次增大,其中基态Y原子s能级电子数是p能级的两倍,Z和M位于同一主族,由上述五种元素形成的化合物可作离子导体,结构如图所示。下列说法错误的是


| A.原子半径:M>Y>Z>X | B.非金属性:N>Z>M>Y |
| C.氢化物沸点:Z>N>M>Y | D.同周期中第一电离能小于Z的元素有5种 |
您最近一年使用:0次



