解题方法
1 . 按要求回答下列问题:
(1)用“>”、“<”或“=”填写下列空格:
① 熔点:金刚石___________ SiC
② 键角:NH3___________ CH4
③ 原子的核外电子排布中,未成对电子数: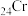
___________ 
④ A、B元素的价电子排布分别为3d104s1、 3d84s2, 第二电离能:A___________ B
(2)已知四氯化铅主要用于有机盐合成,其熔点为-15℃,沸点为50℃,则PbCl4晶体类型为___________ ,空间构型为___________ 。
(3)SiO2晶体结构片断如下图1所示。SiO2晶体中:Si原子数目和Si-O键数目的比例为___________ 。 某氧化亚铁晶体的晶胞如图2所示,与Fe2+紧邻且等距离的Fe2+数目为___________ 。
(1)用“>”、“<”或“=”填写下列空格:
① 熔点:金刚石
② 键角:NH3
③ 原子的核外电子排布中,未成对电子数:
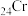

④ A、B元素的价电子排布分别为3d104s1、 3d84s2, 第二电离能:A
(2)已知四氯化铅主要用于有机盐合成,其熔点为-15℃,沸点为50℃,则PbCl4晶体类型为
(3)SiO2晶体结构片断如下图1所示。SiO2晶体中:Si原子数目和Si-O键数目的比例为

您最近一年使用:0次
名校
2 . 锂-磷酸氧铜电池正极的活性物质是 CuO(PO4),可通过下列反应制备∶2Na3PO4+4CuSO4+2NH3 H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O;请回答下列问题∶
H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O;请回答下列问题∶
(1)上述化学方程式中涉及的第三周期元素的第一电离能由小到大的顺序是_____
(2)基态 S原子的价电子排布式为_______ 。
(3)(NH4)2SO4晶体内不存在_______ 。(填序号)
①离子键 ②极性共价键 ③非极性共价键 ④配位键 ⑤范德华力
(4)PO 的立体构型是
的立体构型是_______ ,其中P原子的杂化方式为_______ 。
(5)硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键数目为_______ ,1 mol [Cu(CN))]2-中含有的σ键数目为_______ 。
 H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O;请回答下列问题∶
H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O;请回答下列问题∶(1)上述化学方程式中涉及的第三周期元素的第一电离能由小到大的顺序是
(2)基态 S原子的价电子排布式为
(3)(NH4)2SO4晶体内不存在
①离子键 ②极性共价键 ③非极性共价键 ④配位键 ⑤范德华力
(4)PO
 的立体构型是
的立体构型是(5)硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键数目为
您最近一年使用:0次
解题方法
3 . 根据下列五种元素的电离能数据(单位∶ kJ/mol),回答下列问题。
(1)在周期表中,最可能处于同一族的是_______ 。
A.Q和 R B.S和T C. T和U D.R和T E.R和U
(2)电解它们的熔融氯化物,以下过程最可能正确的是_________ 。
A.Q2++2e-→Q B.R2++2e-→R
C.S3++3e-→S D.T3++3e-→T
(3)它们的氯化物的化学式,最可能正确的是________
A. QCl2 B. RCl C. SCl3 D.TCl
(4)S 元素最可能是________ 素
A.S区元素 B.稀有气体元素 C.p 区元素 D .准金属
(5)下列元素中,化学性质和物理性质最像Q元素的是_____ 。
A.氦(1s2) B.铍(1s12s2) C.锂(1s22s1) D.氢(1s1)
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.Q和 R B.S和T C. T和U D.R和T E.R和U
(2)电解它们的熔融氯化物,以下过程最可能正确的是
A.Q2++2e-→Q B.R2++2e-→R
C.S3++3e-→S D.T3++3e-→T
(3)它们的氯化物的化学式,最可能正确的是
A. QCl2 B. RCl C. SCl3 D.TCl
(4)S 元素最可能是
A.S区元素 B.稀有气体元素 C.p 区元素 D .准金属
(5)下列元素中,化学性质和物理性质最像Q元素的是
A.氦(1s2) B.铍(1s12s2) C.锂(1s22s1) D.氢(1s1)
您最近一年使用:0次
2021-05-08更新
|
712次组卷
|
4卷引用:福建省福州市金山中学2020-2021学年高二下期中考试化学试题
福建省福州市金山中学2020-2021学年高二下期中考试化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)第一章原子结构与性质(基础卷)浙江省绍兴蕺山外国语学校2021-2022学年高二下学期第一次月考化学试题
4 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:

(1)K的元素名称为___________ 。
(2)基态时Q元素原子的电子排布式___________ ,
(3)下列对比正确的是___________ 。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为___________ 。
(5)元素B和C的气态氢化物热稳定性较强的是___________ (填化学式)。

(1)K的元素名称为
(2)基态时Q元素原子的电子排布式
(3)下列对比正确的是
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为
(5)元素B和C的气态氢化物热稳定性较强的是
您最近一年使用:0次
2021-05-07更新
|
372次组卷
|
3卷引用:福建省福清西山学校高中部2020-2021学年高二下学期期中考试化学试题
福建省福清西山学校高中部2020-2021学年高二下学期期中考试化学试题内蒙古自治区赤峰市赤峰二中2020-2021学年高二下学期第二次月考化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)
解题方法
5 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)F-的结构示意图:___________ 。
(2)D的气态氢化物的VSEPR模型为___________ ,其中心原子的杂化类型为___________ ,分子的空间构型为___________ 。
(3)G、H和I的第一电离能数值由大到小的顺序为:___________ (用元素符号作答)。
(4)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有___________ (填元素符号)。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是___________ (填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___________ (填分子式)。
| A | R | ||||||||||||||||
| B | C | D | E | F | T | ||||||||||||
| G | H | I | J | K | L | ||||||||||||
| M | N |
试回答下列问题:
(1)F-的结构示意图:
(2)D的气态氢化物的VSEPR模型为
(3)G、H和I的第一电离能数值由大到小的顺序为:
(4)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有
您最近一年使用:0次
2021-05-07更新
|
561次组卷
|
2卷引用:福建省南平市邵武市第七中学2020-2021学年高二下学期期中考试化学试题
6 . (1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置___________ 。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质含有的化学键类型有___________ (填序号)。
a.离子键 b.极性键 c.非极性键 d.金属键e.配位键f.氢键
②基态铜原子的核外电子排布式为___________ 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:



①晶体Q中各种微粒间的作用力不涉及___________ (填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为___________ ,阴离子的中心原子轨道采用___________ 杂化。
(4)已知苯酚( )具有弱酸性,其Ka=1.1 ×10-10;水杨酸离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸离子 能形成分子内氢键。据此判断,相同温度下酸性强弱比较:水杨酸离子
能形成分子内氢键。据此判断,相同温度下酸性强弱比较:水杨酸离子___________ 苯酚(填“>”或“<”),其原因是___________ 。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2
 NF3+3NH4F
NF3+3NH4F①上述化学方程式中的5种物质含有的化学键类型有
a.离子键 b.极性键 c.非极性键 d.金属键e.配位键f.氢键
②基态铜原子的核外电子排布式为
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:



①晶体Q中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为
(4)已知苯酚(
 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸离子 能形成分子内氢键。据此判断,相同温度下酸性强弱比较:水杨酸离子
能形成分子内氢键。据此判断,相同温度下酸性强弱比较:水杨酸离子
您最近一年使用:0次
7 . 回答下列问题:
(1)与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是_______ 。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:_______ 。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子排布式:_______ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_______ 。
(1)与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
| 元素 | Mn | Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子排布式:
您最近一年使用:0次
名校
解题方法
8 . 叶绿素是绿色植物进行光合作用所必需的催化剂,其结构如图所示。

(1)基态镁原子中核外电子的运动状态有___________ 种,能量最高的电子占据的轨道呈___________ 形。根据对角线规则,Mg的一些化学性质与元素___________ 相似。
(2)C、N、O三种非金属元素的第一电离能由大到小顺序是___________ 。
(3)叶绿素分子中,N原子的杂化类型是___________ 。
(4)MgCO3的热分解温度___________ (填“高于”或“低于”)CaCO3的原因是 ___________ 。
(5)MgS具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgS的晶胞参数为0.52nm,则S2-半径为___________ nm(保留两位有效数字),晶体密度是___________ g·cm-3 (设NA为阿伏加德罗常数的值,列出计算式)。


(1)基态镁原子中核外电子的运动状态有
(2)C、N、O三种非金属元素的第一电离能由大到小顺序是
(3)叶绿素分子中,N原子的杂化类型是
(4)MgCO3的热分解温度
(5)MgS具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgS的晶胞参数为0.52nm,则S2-半径为

您最近一年使用:0次



