名校
1 . 回答下列问题
(1)现有5种元素A、B、C、D、E,其中有3种金属元素,1种稀有气体元素,其I1~I3分别如下表。
根据表中数据判断其中的金属元素为___________ ,稀有气体元素为___________ ,显正二价的金属元素是___________ 。(填字母)
(2)水分子是H2O而不是H3O,是因为共价键具有___________ 性;水分子的键角为105°,是因为共价键具有___________ 性。
(3)1mol乙酸分子CH3COOH中含有的π键与σ键的数目之比为___________ 。
(4)已知NH5为离子化合物,则1molNH5晶体中含有的共价键数目为___________ 。
(1)现有5种元素A、B、C、D、E,其中有3种金属元素,1种稀有气体元素,其I1~I3分别如下表。
| 元素 | I1/eV | I2/eV | I3/eV |
| A | 13.0 | 23.9 | 40.0 |
| B | 4.3 | 31.9 | 47.8 |
| C | 5.7 | 47.4 | 71.8 |
| D | 7.7 | 15.1 | 80.3 |
| E | 21.6 | 41.1 | 65.2 |
(2)水分子是H2O而不是H3O,是因为共价键具有
(3)1mol乙酸分子CH3COOH中含有的π键与σ键的数目之比为
(4)已知NH5为离子化合物,则1molNH5晶体中含有的共价键数目为
您最近一年使用:0次
解题方法
2 . 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线图。请回答以下问题:
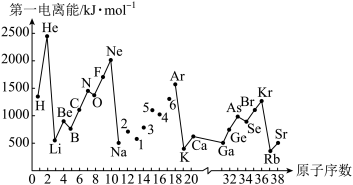
(1)认真分析图中同周期元素第一电离能的变化规律,将Na—Ar之间六种元素用短线连接起来,构成完整的图象____ 。
(2)从图分析可知,同一主族元素原子第一电离能I1变化规律____ 。
(3)图中5号元素在周期表中的位置是____ 、电子排布____ 。
(4)图中N元素比O元素第一电离能高的原因是____ 。
(5)C、H元素形成的化合物分子中共有14个电子,该分子中____ 个σ键,____ 个π键,中心原子杂化模式____ ,分子空间构型____ 。

(1)认真分析图中同周期元素第一电离能的变化规律,将Na—Ar之间六种元素用短线连接起来,构成完整的图象
(2)从图分析可知,同一主族元素原子第一电离能I1变化规律
(3)图中5号元素在周期表中的位置是
(4)图中N元素比O元素第一电离能高的原因是
(5)C、H元素形成的化合物分子中共有14个电子,该分子中
您最近一年使用:0次
3 . NH3在工农业生产中具有重要的作用,可以用来生产尿素(结构简式为: )等化学肥料,也可以用来制备一些配位化合物。
)等化学肥料,也可以用来制备一些配位化合物。
(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂。请写出Fe元素的基态原子的电子排布式:_______ 。
(2)工业上生产尿素的化学反应: ,则CO(NH2)2分子中C原子的杂化方式为
,则CO(NH2)2分子中C原子的杂化方式为_______ 。C、N、O三种元素的第一电离能由小到大的顺序为_______ 。
(3)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的 晶体,与该物质中的配体互为等电子体的阴离子的化学式为
晶体,与该物质中的配体互为等电子体的阴离子的化学式为_______ 。
(4)写出将过量氨水缓慢滴入硫酸铜溶液中发生反应的离子方程式:_______ 、_______ 。
 )等化学肥料,也可以用来制备一些配位化合物。
)等化学肥料,也可以用来制备一些配位化合物。(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂。请写出Fe元素的基态原子的电子排布式:
(2)工业上生产尿素的化学反应:
 ,则CO(NH2)2分子中C原子的杂化方式为
,则CO(NH2)2分子中C原子的杂化方式为(3)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的
 晶体,与该物质中的配体互为等电子体的阴离子的化学式为
晶体,与该物质中的配体互为等电子体的阴离子的化学式为(4)写出将过量氨水缓慢滴入硫酸铜溶液中发生反应的离子方程式:
您最近一年使用:0次
4 . 氮元素及其化合物在生产、生活中用途广泛。回答下列问题:
(1)基态氮原子的价电子排布式为___________ 。
(2)与N同周期的元素中第一电离能比N大的元素有____________ 种。
(3)三硝基胺N(NO2)3(其结构为 )是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为
)是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为___________ ,并且与三个硝基中的N构成___________ 形。
(4)(CN)2、(SCN)2的性质与卤素单质的相似,称为拟卤素。其分子内各原子均达到8电子稳定结构,则1mol(CN)2分子中含___________ molπ键,SCN-的空间构型为___________ 形。
(5)白磷在氯气中燃烧可以得到PCl3和PCl5,研究发现固态PCl4和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的原因:___________ 。
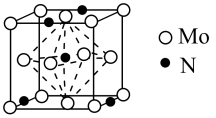
(6)过渡金属氮化物因其优异的催化性能(加氢处理、光和电化学催化等)受到了广泛关注。贵金属钼(Mo)的氮化物可作将N2还原为氨的反应的催化剂。贵金属钼的氮化物的立方晶胞如图所示。已知晶胞参数为anm,则该晶体的化学式为___________ ,晶体的密度为___________ (列出计算式)g·cm-3。
(1)基态氮原子的价电子排布式为
(2)与N同周期的元素中第一电离能比N大的元素有
(3)三硝基胺N(NO2)3(其结构为
 )是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为
)是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为(4)(CN)2、(SCN)2的性质与卤素单质的相似,称为拟卤素。其分子内各原子均达到8电子稳定结构,则1mol(CN)2分子中含
(5)白磷在氯气中燃烧可以得到PCl3和PCl5,研究发现固态PCl4和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的原因:
(6)过渡金属氮化物因其优异的催化性能(加氢处理、光和电化学催化等)受到了广泛关注。贵金属钼(Mo)的氮化物可作将N2还原为氨的反应的催化剂。贵金属钼的氮化物的立方晶胞如图所示。已知晶胞参数为anm,则该晶体的化学式为

您最近一年使用:0次
2021高三·全国·专题练习
5 . 回答下列问题
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性小的元素是___________ ;26号元素价层电子排布式为___________ ;L原子核外电子占有9个轨道,而且有一个未成对电子,L是___________ 元素。
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
①基态硒原子的价层电子排布式为___________ 。
②锗、砷、硒三种元素的第一电离能大小排序为___________ 。
(3)①Cu元素基态原子的价层电子排布式为___________ 。
②下列说法正确的是___________ (填字母)。
A.第一电离能:As>Ga
B.电负性:As>Ga
C.原子半径:As>Ga
③锗(Ge)是用途很广的半导体材料,基态锗原子的价层电子排布式为___________ 。在第二周期中,第一电离能位于硼元素与氮元素之间的元素有___________ 种。
④硼(B)及其化合物在化学中有重要的地位。Ga与B同主族,Ga的基态原子的核外电子排布式为___________ ,B、C、O三种元素的第一电离能由大到小的顺序是___________ 。
(4)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物X2Y3,Z元素可以形成负一价离子。
①X元素基态原子的电子排布式为___________ ,该元素的化学符号是___________ 。
②Y元素原子的价层电子排布图为___________ ,该元素的名称是___________ 。
③已知化合物X2Y3在稀硫酸中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________ 。
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性小的元素是
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
①基态硒原子的价层电子排布式为
②锗、砷、硒三种元素的第一电离能大小排序为
(3)①Cu元素基态原子的价层电子排布式为
②下列说法正确的是
A.第一电离能:As>Ga
B.电负性:As>Ga
C.原子半径:As>Ga
③锗(Ge)是用途很广的半导体材料,基态锗原子的价层电子排布式为
④硼(B)及其化合物在化学中有重要的地位。Ga与B同主族,Ga的基态原子的核外电子排布式为
(4)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物X2Y3,Z元素可以形成负一价离子。
①X元素基态原子的电子排布式为
②Y元素原子的价层电子排布图为
③已知化合物X2Y3在稀硫酸中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
您最近一年使用:0次
6 . 请回答下列问题:
(1) 是共价化合物,各原子均满足8电子稳定结构,写出该化合物的电子式
是共价化合物,各原子均满足8电子稳定结构,写出该化合物的电子式_______ 。
(2) 、
、 、
、 气体都容易液化的原因是
气体都容易液化的原因是_______ 。
(3)使一个稳定状态的气态原子失去1个电子生成+1价的气态阳离子所需的能量称为第一电离能,用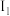 表示;由+1价的气态阳离子失去1个电子所需的能量称为第二电离能,用
表示;由+1价的气态阳离子失去1个电子所需的能量称为第二电离能,用 表示,依次类推。已知某元素X的电离能
表示,依次类推。已知某元素X的电离能 数据如表:
数据如表:
该元素X可能为_______(填序号)。
(1)
 是共价化合物,各原子均满足8电子稳定结构,写出该化合物的电子式
是共价化合物,各原子均满足8电子稳定结构,写出该化合物的电子式(2)
 、
、 、
、 气体都容易液化的原因是
气体都容易液化的原因是(3)使一个稳定状态的气态原子失去1个电子生成+1价的气态阳离子所需的能量称为第一电离能,用
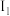 表示;由+1价的气态阳离子失去1个电子所需的能量称为第二电离能,用
表示;由+1价的气态阳离子失去1个电子所需的能量称为第二电离能,用 表示,依次类推。已知某元素X的电离能
表示,依次类推。已知某元素X的电离能 数据如表:
数据如表:电离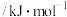 | 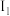 |  | 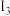 | 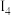 |  | 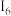 | …… |
| X | 495.8 | 4562 | 6910 | 9543 | 13354 | 16613 |
该元素X可能为_______(填序号)。
| A.Na | B.Mg | C.Al | D.Si |
您最近一年使用:0次
名校
解题方法
7 . 已知A、B、C、D都是短周期元素,它们的原子半径大小顺序为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。
试回答下列问题(用元素符号或化学式表示):
(1)基态B原子中,核外存在___________ 个未成对电子。
(2)基态E2+的核外电子排布式为___________ 。
(3)基态D原子的最高能层的电子排布图为___________
(4)M分子中B原子轨道的杂化类型为___________ 。
(5)B、C、D三种元素的第一电离能由小到大的顺序为___________ 。
试回答下列问题(用元素符号或化学式表示):
(1)基态B原子中,核外存在
(2)基态E2+的核外电子排布式为
(3)基态D原子的最高能层的电子排布图为
(4)M分子中B原子轨道的杂化类型为
(5)B、C、D三种元素的第一电离能由小到大的顺序为
您最近一年使用:0次
2021-10-26更新
|
290次组卷
|
5卷引用:天津市蓟州区燕山中学2021-2022学年高三上学期第一次月考化学试题
名校
8 . 按要求完成下列各题。
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
(2) 成为阳离子时首先失去
成为阳离子时首先失去___________ 轨道电子, 的价层电子排布式为
的价层电子排布式为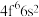 ,
, 价层电子排布式为
价层电子排布式为___________ 。
(3) 基态核外电子排布式为
基态核外电子排布式为___________ 。
(4)下列 原子电子排布图表示的状态中,能量最低和最高的分别为
原子电子排布图表示的状态中,能量最低和最高的分别为___________ 、___________ (填标号)。
A. B.
B.
C. D.
D.
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
A. | B. | C. | D. |
 成为阳离子时首先失去
成为阳离子时首先失去 的价层电子排布式为
的价层电子排布式为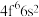 ,
, 价层电子排布式为
价层电子排布式为(3)
 基态核外电子排布式为
基态核外电子排布式为(4)下列
 原子电子排布图表示的状态中,能量最低和最高的分别为
原子电子排布图表示的状态中,能量最低和最高的分别为A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
名校
解题方法
9 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵【(NH4)3Fe(C6H5O7)2】。
(1)Fe2+基态核外电子排布式为___ ;NO 的空间构型为
的空间构型为___ (用文字描述)。
(2)NH3分子中氮原子的轨道杂化类型是___ ;C、N、O元素的第一电离能由大到小的顺序为___ 。
(3)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为=__ mol。
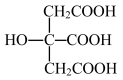
(4)利用键能数据计算反应的ΔH(请写出解题过程):N2(g)+3H2(g)=2NH3(g)。___
(1)Fe2+基态核外电子排布式为
 的空间构型为
的空间构型为(2)NH3分子中氮原子的轨道杂化类型是
(3)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为=

(4)利用键能数据计算反应的ΔH(请写出解题过程):N2(g)+3H2(g)=2NH3(g)。
| 化学键 | H—H | N—H | N≡N |
| 键能/(kJ·mol-1) | 436 | 393 | 946 |
您最近一年使用:0次
2021-10-14更新
|
238次组卷
|
2卷引用:江苏省泗阳县实验高级中学2021-2022学年高二上学期第一次质量调研化学试题
名校
解题方法
10 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+价电子排布图为___________ 。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是___________ 。I1(Be)>I1(B)>I1(Li),原因是___________ 。熔点Li2O___________ Na2O(填“>”或“<”)。
(3)磷酸根离子的空间构型为___________ ,其中P的杂化轨道类型为___________ ;与PO 互为等电子体的阴离子有
互为等电子体的阴离子有___________ (写出一种离子符号)。
(4)金刚石与石墨都是碳的同素异形体。金刚石属于___________ 晶体。若碳原子半径为rnm,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________ (用含π的代数式表示)。

(1)基态Fe2+价电子排布图为
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是
I1/(kJ/mol) | ||
Li:520 | Be:900 | B:801 |
Na:496 | Mg:738 | Al:578 |
 互为等电子体的阴离子有
互为等电子体的阴离子有(4)金刚石与石墨都是碳的同素异形体。金刚石属于

您最近一年使用:0次



