2021高三·全国·专题练习
名校
解题方法
1 . 电负性越大,元素的非金属性越强,第一电离能也越大。(____)
您最近一年使用:0次
2021-12-03更新
|
659次组卷
|
7卷引用:天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题
天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)人教2019选择性必修2第一章第二节 原子结构与元素的性质课后习题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第五章 物质结构与性质 元素周期律 第27讲 元素周期表和元素周期律1.3.2元素的电离能、电负性及其变化规律(课中)-鲁科版选择性必修2(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
2 . 下列说法正确的是
| A.电负性:Se>As | B.离子半径:Na+>Cl− |
| C.第一电离能:Al>Mg | D.键长:Cl−Cl>Br−Br |
您最近一年使用:0次
2022-01-07更新
|
500次组卷
|
6卷引用:天津市南开区2021-2022学年高三上学期期末考试化学试卷
2023·全国·模拟预测
名校
解题方法
3 . 六方氮化硼(BN)被称为“白色石墨烯”,其纳米片可用于以乙烯-乙酸乙烯酯共聚物为基体的导热复合材料中。下列有关说法正确的是
| A.基态N原子中有2个未成对电子 | B.石墨烯中碳原子的杂化方式为 杂化 杂化 |
C.乙烯分子中 键和 键和 键个数之比为4∶1 键个数之比为4∶1 | D.BN中N的化合价为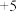 价 价 |
您最近一年使用:0次
名校
解题方法
4 . 含ⅥA族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)基态O原子电子占据最高能级的电子云轮廓图为_______ 形。
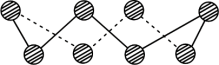
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是_______ 。
(3)Se的核外M层电子的排布式为_______ 。
(4)关于物质I~Ⅳ,下列说法正确的有_______ 。
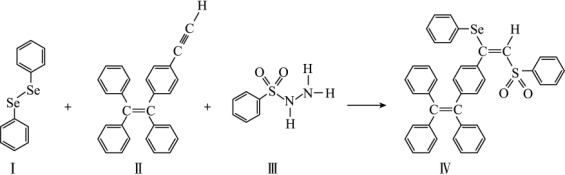
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.I易溶于水
D.II中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅳ含有的元素中,O电负性最大
(5)常温下CO2是气体而CS2是液体的原因是_______ 。
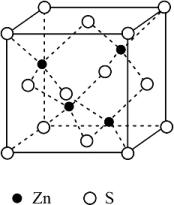
(6)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有_______ 个。晶胞棱长为apm,密度为_______ gcm3(NA表示阿伏加德罗常数的值)。
(1)基态O原子电子占据最高能级的电子云轮廓图为
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)Se的核外M层电子的排布式为
(4)关于物质I~Ⅳ,下列说法正确的有

A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.I易溶于水
D.II中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅳ含有的元素中,O电负性最大
(5)常温下CO2是气体而CS2是液体的原因是
(6)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有

您最近一年使用:0次
5 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A元素原子1s轨道只有1个电子;B元素原子第二能层的最高能级不同轨道上都有电子,并且自旋方向相同;C元素原子的价层电子排布是 ;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
(1)A原子的电子式:___________ 。
(2)B原子的轨道表示式:___________ 。
(3)A、B、C三种元素的电负性:___________ >___________ >___________
(4)B、C、D元素的第一电离能:___________ >___________ >___________
(5)已知E元素原子逐级失去电子的电离能分别为578、1817、2745、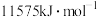 。
。
①E元素原子逐级电离能越来越大的原因:___________ 。
②这些数据说明E的最高正化合价为___________ 。
(6)关于F元素:
①位于周期表的___________ 区;
②它的价电子排布式为___________ ;
③气态的+3价F离子较+2价F离子再失去一个电子更难,其原因是:___________ 。
 ;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。(1)A原子的电子式:
(2)B原子的轨道表示式:
(3)A、B、C三种元素的电负性:
(4)B、C、D元素的第一电离能:
(5)已知E元素原子逐级失去电子的电离能分别为578、1817、2745、
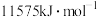 。
。①E元素原子逐级电离能越来越大的原因:
②这些数据说明E的最高正化合价为
(6)关于F元素:
①位于周期表的
②它的价电子排布式为
③气态的+3价F离子较+2价F离子再失去一个电子更难,其原因是:
您最近一年使用:0次
6 . 根据元素周期表中完整周期元素的性质,填写下列空白。
(1)在第三周期中,第一电离能最小的元素符号是_______ ,其原子的结构示意图为_______ ,第一电离能最大的元素符号是_______ ,其电子排布式为_______ 。
(2)在元素周期表中,电负性最大的元素名称是_______ ,其价电子排布图为_______ 。
(3)第四周期元素中未成对电子数最多的元素符号是_______ ,其基态原子的简化电子排布式为_______ ,有_______ 个未成对电子,有_______ 个能级,能量最高的能级符号为_______ 。
(4)某元素的基态原子价电子排布式为3d104s1 ,该元素符号是_______ ,原子中所有电子占有_______ 个轨道,核外共有_______ 个不同运动状态的电子。
(5)某元素的正三价离子的3d能级为半充满,其硫酸盐水溶液显_______ 性(填“酸”、“碱”或“中”),用离子方程式解释其原因_______ 。
(6)用惰性电极电解第三周期原子半径最大的元素的氯化物的水溶液,其阳极反应的电极方程式为_______ 。电解一段时间后,阴极区pH_______ (填“增大”、“减小”或“不变”)
(1)在第三周期中,第一电离能最小的元素符号是
(2)在元素周期表中,电负性最大的元素名称是
(3)第四周期元素中未成对电子数最多的元素符号是
(4)某元素的基态原子价电子排布式为3d104s1 ,该元素符号是
(5)某元素的正三价离子的3d能级为半充满,其硫酸盐水溶液显
(6)用惰性电极电解第三周期原子半径最大的元素的氯化物的水溶液,其阳极反应的电极方程式为
您最近一年使用:0次
名校
7 . 金属钛(Ti)被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)基态Ti原子的电子排布式为[Ar]___________ ,Ti原子核外有___________ 种空间运动状态不同的电子。
(2)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是___________ ,H、B、Ti的电负性由大到小的顺序为___________ 。
(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
①乙二胺中,N原子的杂化方式为___________ 。
②1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为___________ mol。
③乙二胺形成配合物后,H-N-H键角将变大,原因是___________ 。
(4)钙钛矿(主要成分CaTiO3),晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则相距最近的Ca和O之间的距离为___________ pm(列出计算式)。

(1)基态Ti原子的电子排布式为[Ar]
(2)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
①乙二胺中,N原子的杂化方式为
②1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为
③乙二胺形成配合物后,H-N-H键角将变大,原因是
(4)钙钛矿(主要成分CaTiO3),晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则相距最近的Ca和O之间的距离为

您最近一年使用:0次
2022-03-10更新
|
231次组卷
|
2卷引用:天津市滨海新区七所重点学校2021-2022学年高三下学期联考化学试题
名校
8 . 短周期主族元素 、
、 、
、 、
、 原子序数依次增大,
原子序数依次增大, 元素的单质在自然界存在硬度很大的矿石,
元素的单质在自然界存在硬度很大的矿石, 原子最外层有
原子最外层有 个电子,
个电子, 元素的氧化物可做耐高温材料且其最高价氧化物的水化物是难溶于水的碱性物质,
元素的氧化物可做耐高温材料且其最高价氧化物的水化物是难溶于水的碱性物质, 与
与 同主族。下列叙述正确的是
同主族。下列叙述正确的是
 、
、 、
、 、
、 原子序数依次增大,
原子序数依次增大, 元素的单质在自然界存在硬度很大的矿石,
元素的单质在自然界存在硬度很大的矿石, 原子最外层有
原子最外层有 个电子,
个电子, 元素的氧化物可做耐高温材料且其最高价氧化物的水化物是难溶于水的碱性物质,
元素的氧化物可做耐高温材料且其最高价氧化物的水化物是难溶于水的碱性物质, 与
与 同主族。下列叙述正确的是
同主族。下列叙述正确的是A.原子最外层电子数由少到多的顺序: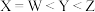 |
B.原子半径由大到小的顺序: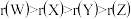 |
C.元素电负性由强到弱的顺序: |
D.元素的最简单气态氢化物的稳定性由强到弱的顺序: 、 、 、 、 |
您最近一年使用:0次
2022-03-10更新
|
225次组卷
|
2卷引用:天津市耀华中学2022届高三第二次模拟考化学试题
9 . I.表中列出了第三周期的几种元素的部分性质:
请按要求回答下列问题:
(1)写出基态a原子的价层电子排布式:____ 。
(2)表中元素原子半径最大的是(写元素符号)_____ 。
(3)a、b、c三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)_____ 。
(4)d、e最高价氧化物对应水化物相互反应的离子方程式为_____ 。
(5)表中五种元素的第一电离能由大到小的顺序是(写元素符号)____ 。
II.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(6)Se原子结构示意图可表示为____ 。
(7)下列说法合理的是____ 。
a.SeO2既有氧化性又有还原性 b.沸点:H2O<H2S<H2Se
c.热稳定性:H2Se<HCl<H2S d.酸性:H2SeO4<HBrO4<HClO4
| 元素编号 | a | b | c | d | e |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出基态a原子的价层电子排布式:
(2)表中元素原子半径最大的是(写元素符号)
(3)a、b、c三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)
(4)d、e最高价氧化物对应水化物相互反应的离子方程式为
(5)表中五种元素的第一电离能由大到小的顺序是(写元素符号)
II.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(6)Se原子结构示意图可表示为
(7)下列说法合理的是
a.SeO2既有氧化性又有还原性 b.沸点:H2O<H2S<H2Se
c.热稳定性:H2Se<HCl<H2S d.酸性:H2SeO4<HBrO4<HClO4
您最近一年使用:0次
名校
10 . 下列说法正确的是
| A.2px、2py、2pz轨道相互垂直,能量不等 |
| B.元素周期表各周期总是从ns能级开始,以np能级结束 |
| C.电负性越大,元素的非金属性越强,第一电离能也越大 |
| D.d区、ds区全部是金属元素 |
您最近一年使用:0次
2021-12-10更新
|
445次组卷
|
2卷引用:天津市南开区南开中学2021-2022学年高二上学期期末检测化学试题



