名校
解题方法
1 . I.非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种
(2) 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3) 中
中 的杂化类型是
的杂化类型是___________ ; 分子的空间结构为
分子的空间结构为___________ 。
(4) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) ,原因是
,原因是___________ 。
II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是___________ 。
A.轨道处于半充满时体系总能量低,核外电子排布应为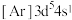
B.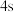 电子能量较高,总是在比
电子能量较高,总是在比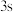 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有(2)
 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)
 中
中 的杂化类型是
的杂化类型是 分子的空间结构为
分子的空间结构为(4)
 的熔、沸点
的熔、沸点 ,原因是
,原因是II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为
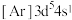
B.
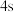 电子能量较高,总是在比
电子能量较高,总是在比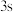 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
您最近一年使用:0次
名校
解题方法
2 . 生物质气(主要成分为CO、CO2、H2等)与H2混合,在含铬催化剂作用下合成甲醇是利用生物质气的方法之一、下列说法正确的是
| A.CO2分子中存在两个相互垂直的π键 | B.电负性:O>N>H>C |
C.NO 的空间构型为三角锥形 的空间构型为三角锥形 | D.基态Cr原子的电子排布式是[Ar]3d44s2 |
您最近一年使用:0次
2020-12-22更新
|
526次组卷
|
4卷引用:【一飞冲天】6.芦台一中一模
名校
3 . 关于如图结构的说法不正确的是( )
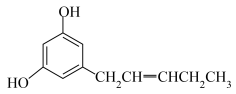

A.分子中既有 键又有π键 键又有π键 |
| B.碳原子有sp、sp2、sp3三种杂化方式 |
| C.O—H键的极性强于C-H键的极性 |
| D.羟基中氧原子采取sp3杂化,VSEPR模型为四面体形 |
您最近一年使用:0次
2019-06-26更新
|
696次组卷
|
8卷引用:天津市耀华中学2021届高三上学期第一次月考化学试题
名校
4 . Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,下列说法正确的是
| A.此化学方程式中涉及的第二周期元素的电负性大小的顺序为O<N<C |
B.配合物K4Fe(CN)6的中心离子的价电子排布图为 ,该中心离子的配位数是10 ,该中心离子的配位数是10 |
| C.1mol[Fe(CN)6]4-分子中含有σ键的数目为12×6.02×1023 |
| D.K2CO3中阴离子的空间构型为三角锥形,其中碳原子的价层电子对数为4 |
您最近一年使用:0次
名校
5 . 如图为长式周期表的一部分,其中的编号代表对应的元素。
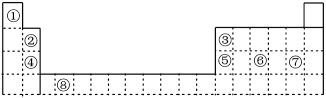
请回答下列问题:
(1)表中属于d区元素的是___ (填元素符号)。
(2)⑧的基态原子最高能层的电子占据能级的电子云轮廓图为___ 。
(3)下列③原子电子排布图表示的状态中,能量最高的为___ (填选项字母)。
(4)元素④的第一电离能___ 元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性___ 元素⑦(选填“>”、“ = ”或“<”)的电负性。
(5)⑥和⑦的最高价氧化物对应的水化物酸性强弱比较___ >___ (填分子式)。
(6)某些不同族元素的性质也有一定的相似性,如表中元素②与元素⑤的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程式___ 。
(7)铟(In)与③同主族,InF3和InI3的熔点分别是1170℃和210℃,熔点差异的原因是___ 。

请回答下列问题:
(1)表中属于d区元素的是
(2)⑧的基态原子最高能层的电子占据能级的电子云轮廓图为
(3)下列③原子电子排布图表示的状态中,能量最高的为
A.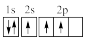 | B.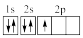 | C. | D.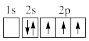 |
(5)⑥和⑦的最高价氧化物对应的水化物酸性强弱比较
(6)某些不同族元素的性质也有一定的相似性,如表中元素②与元素⑤的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程式
(7)铟(In)与③同主族,InF3和InI3的熔点分别是1170℃和210℃,熔点差异的原因是
您最近一年使用:0次
名校
解题方法
6 . W、X、Y、Z、M、N六种元素的原子序数依次递增,其中W、X、Y、Z为短周期元素,六种元素的元素性质或原子结构特征如下表,回答下列问题。
(1)写出元素Z元素周期表中的位置___________ 。
(2)W、X、Y三种元素的电负性数值由大到小的顺序为___________ (用元素符号作答,下同),这三种元素的第一电离能由大到小的顺序为___________ 。
(3)写出元素M的价层电子排布式___________ 。
(4)写出元素N的N3+最外层电子排布式___________ 。
| 元素 | 元素性质或原子结构特征 |
| W | 原子p轨道的电子数为2 |
| X | 原子中最高能级的不同轨道都有电子,且自旋方向相同 |
| Y | 最外能层电子数是最内能层电子数的3倍 |
| Z | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都高于同周期相邻元素 |
| M | 第24号元素 |
| N | 一种常见的金属元素,正三价离子遇硫氰化钾显红色 |
(2)W、X、Y三种元素的电负性数值由大到小的顺序为
(3)写出元素M的价层电子排布式
(4)写出元素N的N3+最外层电子排布式
您最近一年使用:0次
2024-02-22更新
|
124次组卷
|
3卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
名校
7 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素G在周期表中的位置为_______ ,价电子排布式为_______ 。
(2)A、B、C三种元素的第一电离能由大到小为:_______ 。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,键角由大到小的顺序为_______ 。
(4)D、E、F三种元素的电负性由大到小为:_______ 。
(5)电解D与F形成的化合物的水溶液在工业上有着重要应用,其电解的总反应化学方程式为_______ 。阴极产物为_______
(6)工业上冶炼单质E的化学反应方程式_______ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属 |
(2)A、B、C三种元素的第一电离能由大到小为:
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,键角由大到小的顺序为
(4)D、E、F三种元素的电负性由大到小为:
(5)电解D与F形成的化合物的水溶液在工业上有着重要应用,其电解的总反应化学方程式为
(6)工业上冶炼单质E的化学反应方程式
您最近一年使用:0次
解题方法
8 . 硒(Se)的原子序数为34,与氧、硫同主族,下列说法正确的是
| A.硒的最高价是+6价,所以只有一种氧化物SeO3 |
| B.H2Se的热稳定性比H2S差,还原性比H2S弱 |
| C.氧、硫、硒三种元素的电负性递减 |
| D.原子序数为33的元素是砷(As),则砷原子的第一电离能小于硒原子的第一电离能 |
您最近一年使用:0次
名校
9 . 如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
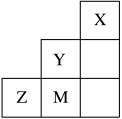

| A.电负性:Z>M>Y |
| B.离子半径:M->Z2->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
D.Z元素基态原子最外层电子轨道表示式为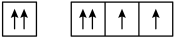 |
您最近一年使用:0次
2020-05-06更新
|
414次组卷
|
9卷引用:天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题
天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题2014-2015宁夏回族自治区银川一中高二上学期期末考试化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】四川省成都外国语学校2019-2020学年高二下学期开学考试化学试题四川省邛崃市高埂中学2019-2020学年度高二下学期期中考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题
名校
10 . 短周期主族元素 、
、 、
、 、
、 、
、 、
、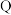 的原子序数依次增加,六种元素分别位于第二、三周期,
的原子序数依次增加,六种元素分别位于第二、三周期, 的最外层电子数等于最内层电子数,
的最外层电子数等于最内层电子数, 的最外层电子数是最内层电子数的
的最外层电子数是最内层电子数的 倍,
倍, 为短周期元素中电负性最强的元素,
为短周期元素中电负性最强的元素, 是短周期元素中原子半径最大的元素,
是短周期元素中原子半径最大的元素, 与
与 同主族,
同主族,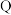 与
与 同主族。已知:短周期主族元素中处于“左上角与右下角相邻对角线位置”的两种元素的化学性质相似。下列说法错误的是
同主族。已知:短周期主族元素中处于“左上角与右下角相邻对角线位置”的两种元素的化学性质相似。下列说法错误的是
 、
、 、
、 、
、 、
、 、
、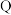 的原子序数依次增加,六种元素分别位于第二、三周期,
的原子序数依次增加,六种元素分别位于第二、三周期, 的最外层电子数等于最内层电子数,
的最外层电子数等于最内层电子数, 的最外层电子数是最内层电子数的
的最外层电子数是最内层电子数的 倍,
倍, 为短周期元素中电负性最强的元素,
为短周期元素中电负性最强的元素, 是短周期元素中原子半径最大的元素,
是短周期元素中原子半径最大的元素, 与
与 同主族,
同主族, 与
与 同主族。已知:短周期主族元素中处于“左上角与右下角相邻对角线位置”的两种元素的化学性质相似。下列说法错误的是
同主族。已知:短周期主族元素中处于“左上角与右下角相邻对角线位置”的两种元素的化学性质相似。下列说法错误的是
A.单质 能与 能与 的最高价氧化物对应的水化物反应 的最高价氧化物对应的水化物反应 |
B.简单氢化物的稳定性: |
C.单质 可以从 可以从 的盐溶液中置换出来单质 的盐溶液中置换出来单质 |
D. 的氧化物为光导纤维的主要成分 的氧化物为光导纤维的主要成分 |
您最近一年使用:0次
2022-08-28更新
|
144次组卷
|
3卷引用:天津西青区2022-2023学年高三上学期期末考试化学试题



