1 . 下列说法中,正确的是
| A.S区全部是金属元素 |
| B.第四周期元素中,未成对电子数最多的元素位于第VIB族 |
| C.第一电离能的大小可以作为判断元素金属性强弱的依据 |
| D.电负性大于1.8的一定是非金属,小于1.8的一定是金属 |
您最近一年使用:0次
名校
解题方法
2 . 氮硼烷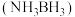 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)基态N原子中电子占据最高能级的电子云轮廓图为_____ 形,基态N原子的电子排布式为_____ 。
(2)B的第一电离能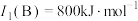 ,判断
,判断
_____ 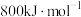 (填“
(填“ ”或“
”或“ ”)。
”)。
(3) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。在H、B、N三种元素中:
。在H、B、N三种元素中:
①电负性由大到小的顺序是_____ 。
②原子半径由大到小的顺序是_____ 。
③在元素周期表中的分区与其他两种不同的元素是_____ 。
(4)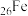 、
、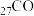 、
、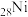 、
、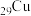 是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
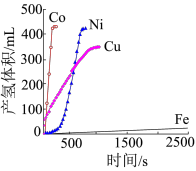
①催化效果最好的金属基态原子中未成对的电子数为_____ 。
②催化效果最差的金属基态原子的价层电子排布式为_____ 。
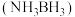 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:(1)基态N原子中电子占据最高能级的电子云轮廓图为
(2)B的第一电离能
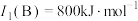 ,判断
,判断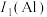
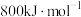 (填“
(填“ ”或“
”或“ ”)。
”)。(3)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。在H、B、N三种元素中:
。在H、B、N三种元素中:①电负性由大到小的顺序是
②原子半径由大到小的顺序是
③在元素周期表中的分区与其他两种不同的元素是
(4)
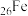 、
、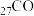 、
、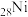 、
、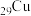 是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
①催化效果最好的金属基态原子中未成对的电子数为
②催化效果最差的金属基态原子的价层电子排布式为
您最近一年使用:0次
解题方法
3 . 已知A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。
(1)写出BA3的电子式___________ 。
(2)B基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈___________ 形。
(3)实验室制备E的单质的离子反应方程式为___________ 。
(4)B和A中非金属性较强的是___________ (填元素的符号)。
(5)C与D的第一电离能大小为___________ 。
(6)G价电子排布图为___________ ,位于___________ 区。
(7)F元素的原子结构示意图为___________ ,前四周期中未成对电子数最多的元素在周期表中位置为___________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/molI2=1451kJ/mol I3=7733kJ/molI4=10540kJ/mol |
| D元素简单离子半径是该周期中最小的 |
| E元素是该周期电负性最大的元素 |
| F所在族的元素种类是周期表中最多的 |
| G在周期表的第十一列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)实验室制备E的单质的离子反应方程式为
(4)B和A中非金属性较强的是
(5)C与D的第一电离能大小为
(6)G价电子排布图为
(7)F元素的原子结构示意图为
您最近一年使用:0次
名校
解题方法
4 . 下列事实的解释不正确的是
| 事实 | 解释 | |
| A |   在任何温度均可自发进行 在任何温度均可自发进行 | 该反应为气体物质的量增大的反应,即 ,同时该反应为放热反应,根据 ,同时该反应为放热反应,根据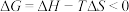 时反应可自发进行知,该反应在任意温度下都能自发进行 时反应可自发进行知,该反应在任意温度下都能自发进行 |
| B |  中 中 键角比 键角比 中的大 中的大 |  的中心原子的孤电子对数为1, 的中心原子的孤电子对数为1, 的中心原子的孤电子对数为2,孤电子对之间的斥力<孤电子对与成键电子对之间的斥力<成键电子对之间的斥力 的中心原子的孤电子对数为2,孤电子对之间的斥力<孤电子对与成键电子对之间的斥力<成键电子对之间的斥力 |
| C | 热稳定性: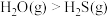 |  分子间能形成氢键 分子间能形成氢键 |
| D | 酸性: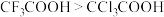 | 氟的电负性大于氯的电负性, 的极性大于 的极性大于 的极性,使 的极性,使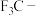 的极性大于 的极性大于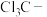 的极性,导致· 的极性,导致· 的羧基中的羟基的极性更大,更易电离出 的羧基中的羟基的极性更大,更易电离出 相对更小 相对更小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 下列说法正确的是( )
| A.原子半径:P<S<Cl |
| B.电负性:C<N<O |
| C.热稳定性:HF<HCl<HBr |
| D.第一电离能:Na<Mg<Al |
您最近一年使用:0次
2020-05-19更新
|
412次组卷
|
6卷引用:天津市红桥区2020届高三下学期居家学习线上检测第一次模拟化学试题
解题方法
6 . 过渡元素镍(Ni)、钒(V)、钛(Ti)等在工业上具有广泛的用途,根据原子结构与周期表及元素的性质,向答下列问题:
(1)镍可形成多种配合物,其中[Ni(NH3)6]SO4所含元素电负性最大的为___ (填元素符号),配位体的电子式为___ ,阴离子的立体构型是___ 。
(2)基态23V原子的电子排布式为___ ,其氧化物V2O5难溶于水,可以由VOCl3(易溶于水)水解来制备,反应的化学方程式为___ 。
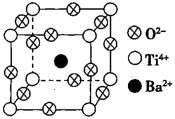
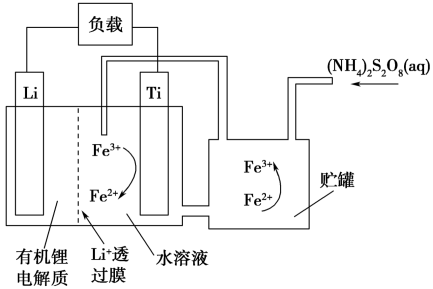
(3)钡钛矿晶体的晶胞结构如图所示,晶胞边长为acm。若该晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则a=___ cm(列出计算式,用ρ表示)。
(4)钛可作为电池电极材料应用,在某种锂离子电池中,电池结构如图。写出钛电极上发生的电极反应式___ ,充电时,钛电极与电源___ 极相连。
(1)镍可形成多种配合物,其中[Ni(NH3)6]SO4所含元素电负性最大的为
(2)基态23V原子的电子排布式为
(3)钡钛矿晶体的晶胞结构如图所示,晶胞边长为acm。若该晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则a=

(4)钛可作为电池电极材料应用,在某种锂离子电池中,电池结构如图。写出钛电极上发生的电极反应式

您最近一年使用:0次
2021-05-14更新
|
235次组卷
|
2卷引用:天津市河北区2021届高三年级总复习质量检测(二)化学试题
7 . 已知A、B、C、D、E为原子序数依次增大的前36号元素,A的2p轨道有3个电子;B是地壳中含量最多的元素;C元素的M层有一个电子;D元素形成的单质具有两性;E的基态原子的电子排布为[Ar]3d104S1。回答下列问题(用元素符号或化学式表示):
(1)A的最高能级电子云呈_______ 形,B的价层电子轨道表达式是_______ 。
(2)D的基态原子核外电子排布式为_______ 。
(3)A、B的第一电离能由小到大顺序是_______ (填元素符号)。
(4)B、C、D的电负性由小到大的顺序为_______ (填元素符号)。
(5)B、C、D的原子半径由小到大的顺序为_______ (填元素符号)。
(6)E在元素周期表中的位置_______ ,位于_______ 区。
(1)A的最高能级电子云呈
(2)D的基态原子核外电子排布式为
(3)A、B的第一电离能由小到大顺序是
(4)B、C、D的电负性由小到大的顺序为
(5)B、C、D的原子半径由小到大的顺序为
(6)E在元素周期表中的位置
您最近一年使用:0次
解题方法
8 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____ 。Ti在元素周期表中的位置____ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____ 。
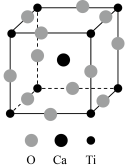
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是____ ;金属离子与氧离子间的作用力为____ ,Ca2+的配位数是____ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是

您最近一年使用:0次
9 . 下列有关描述正确的是
A.键角:NH >H2S>H3O+ >H2S>H3O+ |
| B.酸性:CH3COOH<CH2ClCOOH<CHCl2COOH |
| C.电负性:Br>As>Se |
| D.沸点:CO<N2<HF |
您最近一年使用:0次
名校
解题方法
10 . 下列说法正确的是
| A.S、Cl、K、Ca原子半径逐渐增大 |
B. 的电离方程式为: 的电离方程式为: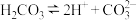 |
C. 和 和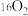 互为同素异形体 互为同素异形体 |
| D.Ge,As,Se、Br的电负性依次增大 |
您最近一年使用:0次



