名校
1 . 下列各组元素中,电负性依次减小的是
| A.F、N、O | B.Cl、C、F | C.As、N、H | D.Cl、S、As |
您最近一年使用:0次
2022-01-21更新
|
373次组卷
|
6卷引用:天津市外国语大学附属外国语学校2021-2022学年高二上学期期末检测化学试题
名校
2 . 近日,我国研究人员利用硫氰酸甲基铵{[CH3NH3]+[SCN]-}气相辅助生长技术,成功制得稳定的钙钛矿型甲脒铅碘(FAPbI3)。请回答下列问题:
(1)基态S原子的价电子排布图为___________ 。
(2)甲脒(FA)的结构简式为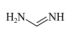
①其组成元素的电负性由小到大的排序为___________ ,其中碳原子的杂化方式为___________ 。
②甲脒比丙烷的熔点更高的原因是___________ 。
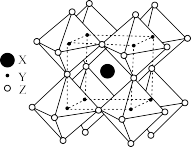
(3)FAPbI3的晶体结构单元如图所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为___________ 。
(1)基态S原子的价电子排布图为
(2)甲脒(FA)的结构简式为

①其组成元素的电负性由小到大的排序为
②甲脒比丙烷的熔点更高的原因是
(3)FAPbI3的晶体结构单元如图所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为

您最近一年使用:0次
2021-10-13更新
|
605次组卷
|
5卷引用:天津市西青区杨柳青第一中学2021--2022 学年高三上学期第一次阶段检测化学试题
天津市西青区杨柳青第一中学2021--2022 学年高三上学期第一次阶段检测化学试题天津市五校2023届高三一模联考化学试题福建省宁化第一中学2021-2022学年高三上学期第二次阶段考试化学试题(已下线)第19讲元素周期律与元素周期表(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
解题方法
3 . 回答下列问题:
(1)如图所示为元素周期表中氮元素部分信息,数据“14.01”表示的是____ ,氮元素原子核外有____ 个未成对电子,最外层有____ 种能量不同的电子。

(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是____ (填编号)。
a.NH3比PH3稳定性强 b.电负性数据:N3.0、P2.1
c.硝酸显强氧化性,磷酸不显强氧化性 d.氮气常温是气体,磷单质是固体
(3)2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
①要证明月壤中含有这些元素,可采用的方法是____ 。
②写出铜的基态原子的电子排布式____ 。
③周期表中,与铜位于同一周期的元素原子中最外层电子数与铜原子的相同的元素有____ (填元素符号)。
(1)如图所示为元素周期表中氮元素部分信息,数据“14.01”表示的是

(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是
a.NH3比PH3稳定性强 b.电负性数据:N3.0、P2.1
c.硝酸显强氧化性,磷酸不显强氧化性 d.氮气常温是气体,磷单质是固体
(3)2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
①要证明月壤中含有这些元素,可采用的方法是
②写出铜的基态原子的电子排布式
③周期表中,与铜位于同一周期的元素原子中最外层电子数与铜原子的相同的元素有
您最近一年使用:0次
名校
解题方法
4 . Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,下列说法正确的是
| A.此化学方程式中涉及的第二周期元素的电负性大小的顺序为O<N<C |
B.配合物K4Fe(CN)6的中心离子的价电子排布图为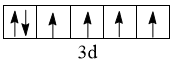 ,该中心离子的配位数是10 ,该中心离子的配位数是10 |
| C.1molHCN分子中含有σ键的数目为1.204×1024 |
| D.K2CO3中阴离子的空间构型为三角锥形,其中碳原子的价层电子对数为4 |
您最近一年使用:0次
2022-06-13更新
|
326次组卷
|
8卷引用:天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题
名校
5 . 胆矾CuSO4•5H2O可写[Cu(H2O)4]SO4•H2O,其结构示意图如图,下列有关胆矾的说法正确的是
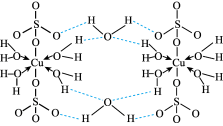
| A.所有氧原子都采取sp3杂化 |
| B.胆矾晶体中含有的粒子间的的作用有离子键、极性键、配位键、氢键4种化学键 |
| C.胆矾所含元素H、O、S的原子半径和电负性依次增大 |
| D.胆矾中的水在不同温度下会分步失去 |
您最近一年使用:0次
6 . 四种元素基态原子的电子排布式如下:① ;②
;② ;③
;③ ;④
;④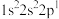 。下列有关比较中正确的是
。下列有关比较中正确的是
 ;②
;② ;③
;③ ;④
;④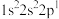 。下列有关比较中正确的是
。下列有关比较中正确的是| A.第一电离能:④>③>②>① | B.原子半径:④>③>①>② |
| C.电负性:③>④>①>② | D.最高正化合价:④=①>③=② |
您最近一年使用:0次
2024-01-24更新
|
145次组卷
|
7卷引用:天津市河北区2020-2021学年高二上学期期末检测化学试题
解题方法
7 . 第三周期元素X、Y、Z的原子序数依次增大,25℃时,0.1mol/L它们最高价氧化物的水化物的溶液,对应的pH分别为13.00、1.57、0.70,下列有关说法正确的是
| A.原子半径:X<Y |
| B.元素电负性:Y<Z |
| C.Y的最高价氧化物的水化物属于强电解质 |
D.Z的最高价氧化物的水化物可能是 |
您最近一年使用:0次
8 . 根据所学化学知识回答下列问题:
(1)基态铁原子的价电子排布式为_______ 。基态硫原子的最外层电子排布的轨道表示式 为_______ 。
(2) 可以与
可以与 形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验
形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验 的存在,KSCN中四种元素的电负性最大的是
的存在,KSCN中四种元素的电负性最大的是_______ (用元素符号表示)。
(3) 中S的价层电子对数为
中S的价层电子对数为_______ , 的键角
的键角_______  的键角(填“>”、“<”或“=”)。
的键角(填“>”、“<”或“=”)。
(4)单质铜及镍都是由_______ 键形成的晶体;某镍铜合金的立方晶胞结构如下图所示。

晶胞中铜原子与镍原子的个数比为_______ 。
(5)SiC的晶体结构与晶体硅类似。SiC的晶体类型为_______ ,晶体中Si原子与Si-C键的数目之比为_______ 。
(1)基态铁原子的价电子排布式为
(2)
 可以与
可以与 形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验
形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验 的存在,KSCN中四种元素的电负性最大的是
的存在,KSCN中四种元素的电负性最大的是(3)
 中S的价层电子对数为
中S的价层电子对数为 的键角
的键角 的键角(填“>”、“<”或“=”)。
的键角(填“>”、“<”或“=”)。(4)单质铜及镍都是由

晶胞中铜原子与镍原子的个数比为
(5)SiC的晶体结构与晶体硅类似。SiC的晶体类型为
您最近一年使用:0次
名校
9 . 用元素周期表中的部分元素及其化合物回答下列问题。
(1)C的基态原子的电子排布式_______ ;Zn在周期表中的位置是_______ 。
(2)C、N、O原子电负性由小到大顺序为_______ ,阴离子 的空间构型为
的空间构型为_______ 。
(3) 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为_______ ,C原子的杂化方式为_______ , 分子为
分子为_______ 。(填“极性分子”或“非极性分子”)
(4)Au与NaCN溶液在 气氛中生成配离子
气氛中生成配离子 ,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:
,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:_______ 。
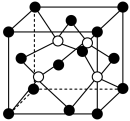
(5)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn,○=S)。与 等距且最近的
等距且最近的 有
有_______ 个。已知该晶胞参数为dnm,晶体密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
_______  。
。
(1)C的基态原子的电子排布式
(2)C、N、O原子电负性由小到大顺序为
 的空间构型为
的空间构型为(3)
 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为 分子为
分子为(4)Au与NaCN溶液在
 气氛中生成配离子
气氛中生成配离子 ,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:
,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:(5)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn,○=S)。与
 等距且最近的
等距且最近的 有
有 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
 。
。
您最近一年使用:0次
10 . 下列各项叙述中,正确的是
| A.N、P、As的电负性随原子序数的增大而增大 |
| B.价电子排布为3d54s2的元素位于第四周期VA族,是p区元素 |
| C.2p和3p轨道形状均为哑铃形,能量也相等 |
D.氮原子的最外层电子排布图: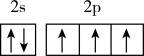 |
您最近一年使用:0次
2022-02-28更新
|
156次组卷
|
2卷引用:天津市第九十五中益中学校2021-2022学年高三上学期第二次月考化学试题



