名校
1 . 依据元素周期律,下列判断不正确 的是
A.第一电离能: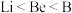 | B.原子半径: |
C.电负性: | D.酸性: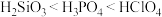 |
您最近一年使用:0次
名校
2 . 下列说法不正确的是
A. 的σ键和π键个数比为4:1 的σ键和π键个数比为4:1 |
| B.某元素气态基态原子的逐级电离能(kJ∙mol−1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+ |
| C.Na、P、Cl的电负性依次增大 |
| D.根据对角线规则,Be也能与NaOH溶液反应 |
您最近一年使用:0次
2022-03-20更新
|
152次组卷
|
3卷引用:黑龙江省哈尔滨市宾县第二中学2022-2023学年高二下学期第二次月考化学试题
名校
3 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y同族但不相邻,基态Z原子价电子排布nsn-1npn+1。下列说法正确的是
| A.简单离子半径:W>Z>Y>X | B.简单阴离子还原性:Z>W |
| C.电负性:Z>W | D.Z与W的简单气态氢化物沸点Z>W |
您最近一年使用:0次
2022-03-03更新
|
406次组卷
|
3卷引用:黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题
黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题山东省聊城市第一中学2021-2022学年高三上学期期末考试化学试题(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题
名校
4 . 现有四种元素的基态原子的电子排布式:①1s22s22p4②1s22s22p63s1③1s22s22p3④1s22s22p5,则下列有关比较中不正确 的是
| A.非金属性:④>①>③ | B.第一电离能:④>③>①>② |
| C.最高正化合价:④>①>③>② | D.电负性:④>①>③>② |
您最近一年使用:0次
2022-02-28更新
|
174次组卷
|
2卷引用:黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题
名校
5 . Ti、Na、Mg、C、N、O、Fe等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是___________ ,能量最低的是___________ (填序号)。
a. b.
b.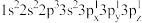
c.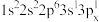 d.
d.
(3)Ti原子位于元素周期表中的___________ 区,最高能层电子的电子云轮廓形状为___________ ,其价电子排布式为___________ 。与Ti同周期的过渡元素中,未成对电子数最多的的基态原子的外围电子的轨道表示式___________ 。
(4)Fe3+与Fe2+的离子半径大小关系为Fe3+___________ Fe2+(填“大于”或“小于”)
(5)下列各组多电子原子的能级能量比较不正确的是___________
①2p=3p ②4s>2s ③4p>4f ④4d>3d
(1)钠在火焰上灼烧的黄光是一种
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是
a.
 b.
b.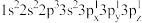
c.
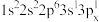 d.
d.
(3)Ti原子位于元素周期表中的
(4)Fe3+与Fe2+的离子半径大小关系为Fe3+
(5)下列各组多电子原子的能级能量比较不正确的是___________
①2p=3p ②4s>2s ③4p>4f ④4d>3d
| A.①④ | B.①③ | C.③④ | D.②③ |
您最近一年使用:0次
2022-02-18更新
|
1359次组卷
|
7卷引用:黑龙江省佳木斯市汤原县高级中学等四校2021-2022学年高二下学期期末联考化学试题
6 . 硅是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态硅(Si)原子的核外电子排布式为[Ne]_______ ,有_______ 个未成对电子。
(2)碳(C)、硅(Si)、锗(Ge)是同族元素。
①基态Ge原子的核外电子占据_______ 个能层、_______ 个能级。
②上述三种元素的电负性由大到小的顺序为_______ (填元素符号)。
③固态CO2可用于人工降雨,SiO2常用于_______ (填一种即可)。
④请写出高温条件下碳和二氧化硅反应的化学方程式:_______ 。
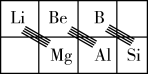
(3)在元素周期表中,某些元素与其右下方的主族元素(如图所示)的一些性质是相似的。如Si与NaOH反应生成Na2SiO3和H2,则B与NaOH反应生成_______ (填化学式)和H2。
(1)基态硅(Si)原子的核外电子排布式为[Ne]
(2)碳(C)、硅(Si)、锗(Ge)是同族元素。
①基态Ge原子的核外电子占据
②上述三种元素的电负性由大到小的顺序为
③固态CO2可用于人工降雨,SiO2常用于
④请写出高温条件下碳和二氧化硅反应的化学方程式:
(3)在元素周期表中,某些元素与其右下方的主族元素(如图所示)的一些性质是相似的。如Si与NaOH反应生成Na2SiO3和H2,则B与NaOH反应生成

您最近一年使用:0次
2022-01-27更新
|
326次组卷
|
3卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2021-2022学年高二下学期开学考试化学试题
7 . 我国北斗导航卫星使用了铷(Rb)原子钟。下列说法正确的是
A. 的第一电离能比 的第一电离能比 的第一电离能低 的第一电离能低 |
B.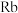 的价电子排布式为 的价电子排布式为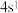 |
C.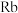 是十分活泼的金属,其电负性为0 是十分活泼的金属,其电负性为0 |
D.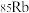 和 和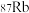 互为同素异形体 互为同素异形体 |
您最近一年使用:0次
2022-01-24更新
|
228次组卷
|
2卷引用:黑龙江省哈尔滨市宾县第二中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
8 . 下列有关比较中错误的是
| A.元素的电负性:N<O<F | B.元素的金属性:Na>Mg>Al |
| C.元素的第一电离能:C<N<O | D.元素的最高正价:P<S<Cl |
您最近一年使用:0次
2022-01-24更新
|
184次组卷
|
5卷引用:黑龙江省绥化市绥棱县第一中学2022-2023学年高二上学期期中考试化学试题
9 . 铜是人类最早使用的金属之一,用黄铜矿(主要成分为CuFeS2)生产粗铜的反应原理如下:
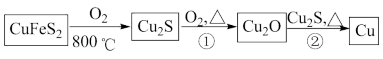
回答下列问题:
(1)第三周期主族元素中电负性比S小的元素有______ 种,H2S分子的空间结构名称为______ ,H2S的沸点比H2O的______ (填“高”或“低”),原因是_____ 。
(2)Cu2O和Cu2S均为________ 晶体,Cu2O的熔点为1235℃,Cu2S的熔点为1130℃,Cu2O熔点较高的原因是______ 。
(3)反应①、②中会生成气体SO2,其中心原子的杂化方式为______ 。
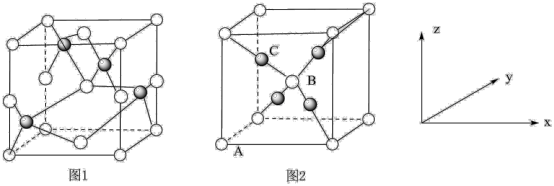
(4)铜的两种氧化物的晶胞如图1、图2所示,图1表示______ (填化学式),图2中,A原子坐标参数为(0,0,0),B原子为( ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为_____ 。若图2表示的晶体的密度为 ,阿伏加德罗常数的值为NA,则图2晶胞中Cu原子与O原子之间的最小距离为
,阿伏加德罗常数的值为NA,则图2晶胞中Cu原子与O原子之间的最小距离为_____ (用含 和NA的式子表示)pm。
和NA的式子表示)pm。
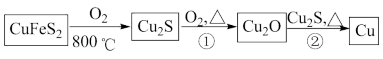
回答下列问题:
(1)第三周期主族元素中电负性比S小的元素有
(2)Cu2O和Cu2S均为
(3)反应①、②中会生成气体SO2,其中心原子的杂化方式为
(4)铜的两种氧化物的晶胞如图1、图2所示,图1表示
 ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为 ,阿伏加德罗常数的值为NA,则图2晶胞中Cu原子与O原子之间的最小距离为
,阿伏加德罗常数的值为NA,则图2晶胞中Cu原子与O原子之间的最小距离为 和NA的式子表示)pm。
和NA的式子表示)pm。
您最近一年使用:0次
2022-01-24更新
|
251次组卷
|
2卷引用:黑龙江省佳木斯市第十二中学2021-2022学年高二下学期期中考试化学试题
10 . 北京化工大学杨占旭教授合成了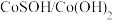 复合催化剂,其在低温条件下能催化水分解制氢,有利于拯救能源危机和缓解环境恶化,其工作原理如图所示。
复合催化剂,其在低温条件下能催化水分解制氢,有利于拯救能源危机和缓解环境恶化,其工作原理如图所示。
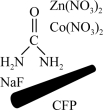

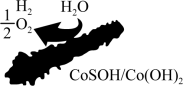
回答下列问题:
(1)基态Co原子的电子排布式为___________ ,其能量最高的能级是___________
(2)Cu的第三电离能比Zn的小,其原因是___________ ;C、N、O、F的电负性由大到小的顺序为___________ 。
(3)尿素可看作是氨基甲酰胺,有一定的弱碱性,其与 、
、 等作用时,生成难溶于水的盐:
等作用时,生成难溶于水的盐: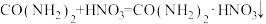 。
。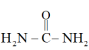 中碳原子的杂化方式是
中碳原子的杂化方式是___________ ,该分子中含有___________ 个σ键。
(4) 的键角
的键角___________ (填“大于”或“小于”) 的键角,其原因为
的键角,其原因为___________ 。
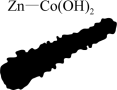
(5)金属锌的晶胞结构如图所示。

①Zn原子的配位数为___________ ;
②该晶体的密度为___________ g/cm3 (列出算式)。
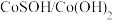 复合催化剂,其在低温条件下能催化水分解制氢,有利于拯救能源危机和缓解环境恶化,其工作原理如图所示。
复合催化剂,其在低温条件下能催化水分解制氢,有利于拯救能源危机和缓解环境恶化,其工作原理如图所示。



回答下列问题:
(1)基态Co原子的电子排布式为
(2)Cu的第三电离能比Zn的小,其原因是
(3)尿素可看作是氨基甲酰胺,有一定的弱碱性,其与
 、
、 等作用时,生成难溶于水的盐:
等作用时,生成难溶于水的盐: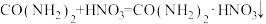 。
。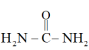 中碳原子的杂化方式是
中碳原子的杂化方式是(4)
 的键角
的键角 的键角,其原因为
的键角,其原因为(5)金属锌的晶胞结构如图所示。

①Zn原子的配位数为
②该晶体的密度为
您最近一年使用:0次



