名校
解题方法
1 . 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 酸性: | 电负性: |
B | 碳酸氢钠用作面团膨松剂 | 碳酸氢钠可以与碱反应 |
C | 马口铁(镀锡铁)出现刮痕后浸泡在饱和食盐水中,一段时间后,滴入几滴 | 锡做原电池的负极 |
D | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝会变红色 | 乙醇具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-24更新
|
335次组卷
|
4卷引用:安徽省安庆市怀宁县高河中学2023-2024学年高二下学期第一次月考化学试题
9-10高二下·江苏泰州·期末
名校
解题方法
2 . 对Na、Mg、Al的有关性质的叙述正确的是:
| A.碱性:NaOH< Mg(OH)2< Al(OH)3 | B.第一电离能:Na< Mg <Al |
| C.还原性:Na> Mg >Al | D.电负性:Na> Mg >Al |
您最近一年使用:0次
2020-11-12更新
|
573次组卷
|
63卷引用:安徽省蚌埠市第二中学2016-2017学年高二下学期期中考试化学试题
安徽省蚌埠市第二中学2016-2017学年高二下学期期中考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题(已下线)09—10年泰州中学高二下学期期末考试化学卷(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015宁夏银川市唐徕回民中学高二下学期3月月考化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A2014-2015学年吉林省汪清县第六中学高二下学期期末考试化学试卷2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷2015-2016学年宁夏六盘山中学高二下第一次月考化学卷2015-2016学年山西太原五中高二下3月第二次周练化学卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年山东省淄博市高青一中高二4月月考化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年吉林东北师大附属实验高二下期末化学试卷2015-2016学年吉林梅河口五中高二下期末化学试卷2015-2016吉林东北师大附属实验学校净月实验学校高二下期末化学卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷2016-2017学年四川省阆中中学高二上教学质检化学试卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题湖北省孝感市七校教学联盟2016-2017学年高二下学期期末考试化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期末考试化学试题河北省深州中学2016-2017学年高二下学期期末考试化学试题内蒙古包头市第三十三中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县协作校2016-2017学年高二下学期期末化学试题吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题福建省福州三中2017-2018学年高二上学期期末考试化学试题云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题黑龙江省鸡西市鸡东县第二中学2018-2019学年高二5月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期期末考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题吉林省延边市长白山第一高级中学2019-2020学年高二下学期验收考试化学试卷吉林省长春市第二十九中学2019-2020学年高二上学期期末考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题四川省平昌县驷马中学2020-2021学年高二上学期九月月考化学试题江苏省东台创新高级中学2019-2020学年高二下学期4月份月检测化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题四川省乐山十校2020-2021学年高二上学期半期联考化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题河南省宏力学校2018-2019学年高二下学期期中考试化学试题内蒙古集宁新世纪中学2020-2021学年高二下学期期末考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 四川省绵阳第一中学2022-2023学年高二上学期9月教学质量监测理科化学试题福建省永春美岭中学2021-2022学年高二下学期期中测试化学试题新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题四川省乐山市沫若中学2022-2023学年高二上学期第一次月考化学试题云南省广南县二中2021-2022年学年高二下学期开学考试化学试题河南省焦作市2022-2023学年第四中学高二下学期3月月考 化学试卷新疆阿克苏市实验中学2022-2023学年高二下学期第一次月考化学试题2020届高三化学二轮物质结构题型专攻——原子结构与性质【基础专练】
名校
解题方法
3 . 前四周期元素X、Y、Z、W的原子序数依次增大,X原子中有6个运动状态不同的电子,Y是地壳中含量最多的元素,基态Z原子K、L层上的电子总数是3p原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法不正确的是
| A.电负性: X < Y,原子半径: X < Y |
| B.同周期中,除稀有气体外元素Z的第一电离能最大 |
| C.在一定条件下,X与氢元素形成的某些化合物与Z的单质及氢化物均能反应 |
D.在一定条件下,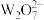 和 和 可以相互转化,且二者均具有强氧化性 可以相互转化,且二者均具有强氧化性 |
您最近一年使用:0次
真题
名校
4 . 日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3。下列说法正确的是
| A.电负性:X>Y>Z>W |
| B.原子半径:X<Y<Z<W |
| C.Y和W的单质都能与水反应生成气体 |
| D.Z元素最高价氧化物对应的水化物具有强氧化性 |
您最近一年使用:0次
2023-06-16更新
|
11329次组卷
|
25卷引用:安徽省亳州市第二完全中学2022-2023学年高二下学期期末考试化学(A卷)试题
安徽省亳州市第二完全中学2022-2023学年高二下学期期末考试化学(A卷)试题山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题2023年高考湖南卷化学真题(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)2023年湖南卷高考真题变式题(选择题6-10)(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第19讲元素周期律与元素周期表(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)湖北省武汉市第六中学2023-2024学年高三上学期第一次月考化学试题江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题天津市耀华中学2023-2024学年高三上学期第一次月考化学试题(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)福建省厦门第一中学2024届高三上学期10 月月考化学试题河北省迁安市2023-2024学年高三上学期期中考试化学试题福州市福州高级中学2023-2024学年高三上学期10月月考化学试题福建省厦门第一中学2024届高三上学期第一次月考化学试题重庆市第七中学校2023-2024学年高三上学期11月月考化学试卷北京市第二十中学2023-2024学年高三上学期10月月考化学试题(已下线)题型01 元素位-构-性推断-2024年高考化学答题技巧与模板构建(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)福建省福州高级中学2023-2024学年高三上学期第一阶段考试化学试卷(已下线)FHgkyldyjhx12
名校
解题方法
5 . 下列原因分析能正确解释性质差异的是
| 选项 | 性质差异 | 原因分析 |
| A | 碱性: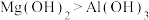 | 第一电离能:Mg>Al |
| B | 沸点: | 键能:H—N>H—P |
| C | 水溶性:丙三醇大于乙醇 | 丙三醇的相对分子质量大于乙醇 |
| D | 酸性: | 电负性氯大于氢,导致 中O—H键极性较大 中O—H键极性较大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-10更新
|
89次组卷
|
2卷引用:安徽省合肥市肥西县2022-2023学年高二下学期期末考试化学试题
名校
解题方法
6 . 已知在有机化合物中,吸电子基团(吸引电子云密度靠近)能力: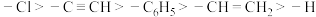 ,推电子基团(排斥电子云密度偏离)能力:
,推电子基团(排斥电子云密度偏离)能力: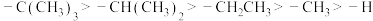 ,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强。下列说法错误的是
,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强。下列说法错误的是
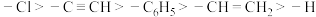 ,推电子基团(排斥电子云密度偏离)能力:
,推电子基团(排斥电子云密度偏离)能力: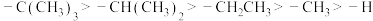 ,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强。下列说法错误的是
,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强。下列说法错误的是A.碱性: > > |
B.羟基的活性: > > |
C.酸性: |
D.碳原子杂化轨道中 成分占比: 成分占比: |
您最近一年使用:0次
名校
7 . 现有A、B、C、D四种元素,A是第五周期第ⅣA族元素,B是第三周期元素,B、C、D的价电子数分别为2、2、7。四种元素原子序数从小到大的顺序是B、C、D、A。已知C和D的次外层电子数均为18个。
(1)写出A、B、C、D的元素符号:A________ 、B________ 、C________ 、D________ 。
(2)C位于元素周期表的________ 区,C2+的电子排布式______________________________ 。
(3)最高价氧化物对应水化物中碱性最强的化合物是________ (写化学式,下同);最高价氧化物对应水化物中酸性最强的化合物是________ 。
(4)元素的第一电离能最小的是________ ,元素的电负性最大的是________ 。
(1)写出A、B、C、D的元素符号:A
(2)C位于元素周期表的
(3)最高价氧化物对应水化物中碱性最强的化合物是
(4)元素的第一电离能最小的是
您最近一年使用:0次
2019-07-22更新
|
316次组卷
|
10卷引用:安徽省合肥市第一中学2022-2023学年高二下学期第一次质量检测化学试题
安徽省合肥市第一中学2022-2023学年高二下学期第一次质量检测化学试题云南省丘北二中2018-2019学年高二下学期期末考试化学试题云南省楚雄州南华县第一中学2019-2020学年高二9月考试化学试题云南省玉溪市江川二中2019-2020学年高二上学期期中考试化学试题云南省禄丰县民族中学2019-2020学年高二12月月考化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题云南省富宁县三中2019-2020学年高二上学期期末考试化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题云南省施甸县第三中学2019-2020学年高二12月月考化学试题(已下线)2019年11月23日 周末培优-学易试题君之每日一题君2020年高考化学一轮复习
名校
8 . 下列说法正确的是( )
| A.电离能大的元素,不易失电子,易得到电子,表现非金属性 |
| B.电离能大的元素其电负性必然也大 |
| C.电负性最大的非金属元素形成的含氧酸的酸性最强 |
| D.电离能最小的元素形成的氧化物的水化物的碱性最强 |
您最近一年使用:0次
2017-03-21更新
|
168次组卷
|
7卷引用:【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期开学考试化学试题
解题方法
9 . 回答下列问题:
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气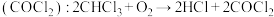 ,光气
,光气 分子的立体构型是
分子的立体构型是________ 形。
(2)某有机物的结构简式为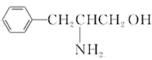 。该有机物分子是
。该有机物分子是____________ (填“极性”或“非极性”)分子,该有机物分子中采取 杂化的原子对应元素的电负性由大到小的顺序为
杂化的原子对应元素的电负性由大到小的顺序为____________ 。
(3)乙二胺 分子中氮原子杂化类型为
分子中氮原子杂化类型为_________________ 。
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸( )是一种弱酸,其分子结构可表示为
)是一种弱酸,其分子结构可表示为 ,肼
,肼 被亚硝酸氧化时便可得到氢叠氮酸
被亚硝酸氧化时便可得到氢叠氮酸 ,发生的反应为
,发生的反应为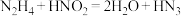 。
。 的酸性和醋酸相近,可微弱电离出
的酸性和醋酸相近,可微弱电离出 和
和 。
。
①叠氮酸根能与许多金属离子等形成配合物,如 ,根据价层电子对互斥理论判断
,根据价层电子对互斥理论判断 的空间构型为
的空间构型为________________ 。
②下列有关说法正确的是_____________ (填序号)。
A. 中含有5个
中含有5个 键
键
B. 中的三个氮原子均采用
中的三个氮原子均采用 杂化
杂化
C. 、
、 、
、 、
、 都是极性分子
都是极性分子
D.肼 的沸点高达
的沸点高达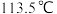 ,说明肼分子间可形成氢键
,说明肼分子间可形成氢键
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气
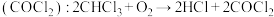 ,光气
,光气 分子的立体构型是
分子的立体构型是(2)某有机物的结构简式为
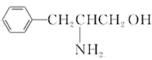 。该有机物分子是
。该有机物分子是 杂化的原子对应元素的电负性由大到小的顺序为
杂化的原子对应元素的电负性由大到小的顺序为(3)乙二胺
 分子中氮原子杂化类型为
分子中氮原子杂化类型为(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(
 )是一种弱酸,其分子结构可表示为
)是一种弱酸,其分子结构可表示为 ,肼
,肼 被亚硝酸氧化时便可得到氢叠氮酸
被亚硝酸氧化时便可得到氢叠氮酸 ,发生的反应为
,发生的反应为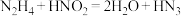 。
。 的酸性和醋酸相近,可微弱电离出
的酸性和醋酸相近,可微弱电离出 和
和 。
。①叠氮酸根能与许多金属离子等形成配合物,如
 ,根据价层电子对互斥理论判断
,根据价层电子对互斥理论判断 的空间构型为
的空间构型为②下列有关说法正确的是
A.
 中含有5个
中含有5个 键
键B.
 中的三个氮原子均采用
中的三个氮原子均采用 杂化
杂化C.
 、
、 、
、 、
、 都是极性分子
都是极性分子D.肼
 的沸点高达
的沸点高达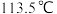 ,说明肼分子间可形成氢键
,说明肼分子间可形成氢键
您最近一年使用:0次
2024-03-27更新
|
54次组卷
|
2卷引用:安徽省皖西当代职业中专学校2023-2024学年高二下学期4月月考化学试题
名校
10 . 我国科学家使用了新的铝铍埋藏测年法测量北京猿人的生存年代。这种方法的测量对象是石英(二氧化硅),它是砂石的主要成分。当宇宙射线打到地面时,会将石英中的硅原子和氧原子打破,生成铝和铍的同位素。只要测出一块石头中26Al和10Be的含量,就能推算出它被埋入地下的时间。完成下列填空:
(1)写出Be的核外电子排布式_______ 。Be所在的周期中,最外层有2个未成对电子的元素的符号是_______ 、_______ 。
(2)写出Al的最外层电子轨道表示式_______ 。铝原子核外有_______ 种运动状态不同的电子;铝原子核外有_______ 种能量不同的电子。有一种与26Al中子数相同的硅的核素,写出该核素符号_______ ,该硅电负性_______ (填“大于”或“小于”)Al 。
(3)比较Al3+、S2-和Cl-半径由大到小的顺序_______ ;这3种元素最高价氧化物对应的水化物中酸性最强的是_______ (写化学式)。
(4)铝单质在氧气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_______ 。铝元素最高价氧化物与氢氧化钠溶液反应的化学方程式_______ 。
(1)写出Be的核外电子排布式
(2)写出Al的最外层电子轨道表示式
(3)比较Al3+、S2-和Cl-半径由大到小的顺序
(4)铝单质在氧气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
您最近一年使用:0次



 溶液,出现蓝色沉淀
溶液,出现蓝色沉淀

