21-22高三下·广西河池·阶段练习
名校
解题方法
1 . 过氧乙酸又名过醋酸(C2H4O3),是重要化工原料。也是一种绿色生态杀菌剂,其制法为CH3COOH+H2O2=CH3COOOH+H2O。
(1)某同学写出了碳原子的4种不同状态的电子排布图____ 。
A.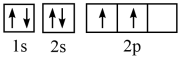 B.
B.
C.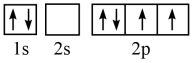 D.
D.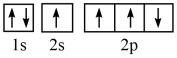
其中能量最低的是____ (填标号),电子由状态C到状态B所得到的光谱为____ 光谱(填“原子发射”或“原子吸收”)。
(2)过氧乙酸分子中C原子的杂化方式有____ 。
(3)乙酸比乙醇易电离出H+的原因____ 。
(4)乙酸和硝酸分子中所包含元素电负性由大到小的顺序是____ (用元素符号表示)。
(5)造纸中,用NaBH4与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如表所示:
解释表中两种物质熔点差异的原因____ 。
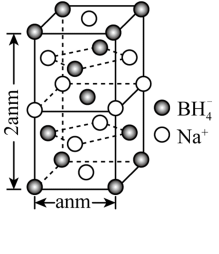
②硼氢化钠晶胞结构如图所示,该晶体中Na+的配位数为____ 。已知:硼氢化钠晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则a=___ nm(用含ρ、NA的最简式子表示)
(1)某同学写出了碳原子的4种不同状态的电子排布图
A.
 B.
B.
C.
 D.
D.
其中能量最低的是
(2)过氧乙酸分子中C原子的杂化方式有
(3)乙酸比乙醇易电离出H+的原因
(4)乙酸和硝酸分子中所包含元素电负性由大到小的顺序是
(5)造纸中,用NaBH4与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如表所示:
| 硼氢化物 | NaBH4 | Al(BH4)3 |
| 熔点/℃ | 400 | -64.5 |
②硼氢化钠晶胞结构如图所示,该晶体中Na+的配位数为

您最近一年使用:0次
2022-06-29更新
|
608次组卷
|
4卷引用:2022年海南省高考真题变式题15-19
(已下线)2022年海南省高考真题变式题15-19广西河池高级中学2022届高三下学期4月考试理科综合化学试题宁夏六盘山高级中学2023-2024学年高三一模考试化学试题天津市第四十五中学2023-2024学年高三12月月考化学试题
2023·四川成都·模拟预测
名校
解题方法
2 . H、N、O、S、Zn、Cu是日常生活中常见的元素。
(1)基态S原子的核外电子排布式为_____ ,其中两种自旋状态的电子数之比为_____ 。
(2)[Cu(NH3)4]SO4·H2O中,电负性最大的元素是_____ (填名称);第一电离能最大的元素是_____ (填名称)。1mol[Cu(NH3)4]2+中含有σ键的数目为_____ 。
(3)硼酸晶体的片层结构如图1所示,其中键角∠B-O-H为114°,则硼酸晶体中氧原子的杂化方式是_____ 。键角∠B-O-H不同于键角∠O-B-O的原因是_____ 。

(4)N原子和P原子的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是__________ 。
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图2所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿z轴从上往下俯视的晶胞投影图如图3所示。

①若图3中原子5的分数坐标是(1, ,
, ),则原子1的分数坐标是
),则原子1的分数坐标是_____ 。
②设阿伏加德罗常数的值为NA,则GaN晶体的密度为_____ g·cm-3。
(1)基态S原子的核外电子排布式为
(2)[Cu(NH3)4]SO4·H2O中,电负性最大的元素是
(3)硼酸晶体的片层结构如图1所示,其中键角∠B-O-H为114°,则硼酸晶体中氧原子的杂化方式是

(4)N原子和P原子的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图2所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿z轴从上往下俯视的晶胞投影图如图3所示。

①若图3中原子5的分数坐标是(1,
 ,
, ),则原子1的分数坐标是
),则原子1的分数坐标是②设阿伏加德罗常数的值为NA,则GaN晶体的密度为
您最近一年使用:0次
3 . 下图是元素周期表的一部分,图中所列字母分别代表一种化学元素。回答下列问题:

(1)j元素基态原子的电子排布式是___________ 。
(2)元素k位于周期表中___________ 区,其基态原子有___________ 个未成对电子,有___________ 种空间运动状态不同的电子。
(3)下列正确的是___________。
(4)基态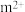 的离子结构示意图为
的离子结构示意图为___________ ,已知高温下化合物 比化合物
比化合物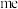 更稳定,试从
更稳定,试从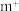 离子的核外电子排布的角度解释原因
离子的核外电子排布的角度解释原因___________ 。
(5)根据对角线规则,b与h的化学性质相似,请写出b的最高价氧化物对应的水化物与 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(6)传闻某国合成了第166号元素,若已知原子结构规律不变,该元素应是第___________ 周期、第___________ 族。

(1)j元素基态原子的电子排布式是
(2)元素k位于周期表中
(3)下列正确的是___________。
A.原子半径 | B.第一电离能 |
C.电负性 | D.最高价氧化物的水化物的酸性 |
(4)基态
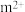 的离子结构示意图为
的离子结构示意图为 比化合物
比化合物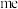 更稳定,试从
更稳定,试从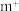 离子的核外电子排布的角度解释原因
离子的核外电子排布的角度解释原因(5)根据对角线规则,b与h的化学性质相似,请写出b的最高价氧化物对应的水化物与
 溶液反应的离子方程式
溶液反应的离子方程式(6)传闻某国合成了第166号元素,若已知原子结构规律不变,该元素应是第
您最近一年使用:0次
名校
解题方法
4 . 氮族、氧族、卤族等在生活生产中都有重要应用。回答下列问题:
(1)NH3分子的VSEPR模型名称为___________ 。配合物 中的H—N—H的键角与游离的
中的H—N—H的键角与游离的 分子的键角比较,前者
分子的键角比较,前者_____ 后者(填“大于”“小于”或“相同”),其原因是___________ 。
(2)已知斥力大小:孤电子对-孤电子对>孤电子对-成键电子对,预测 离子的空间结构为
离子的空间结构为___________ 。
(3)①离子液体优异性能不断被开发利用。常见的离子液体含有如图中的离子等,已知微粒中的大 键可以用
键可以用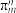 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则阳离子中的大
键中的电子数,则阳离子中的大 键可以表示为
键可以表示为___________ 。为了使正离子以单体形式存在以获得良好的溶解性能,与N原子相连的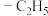 不能被H原子替换,请解释原因:
不能被H原子替换,请解释原因:___________ 。
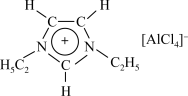
② 也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出
也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出 的结构式
的结构式___________ 。
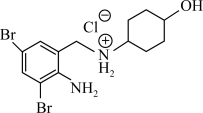
(4)为提高含氮碱性有机药物的水溶性,常用它们的盐酸盐。例如盐酸氨溴索(结构见如图)的阳离子可与水形成氢键,这些氢键表示式为O—H∙∙∙O(H2O)、___________ ,这种盐中C原子的杂化轨道的类型为___________ 。
(1)NH3分子的VSEPR模型名称为
 中的H—N—H的键角与游离的
中的H—N—H的键角与游离的 分子的键角比较,前者
分子的键角比较,前者(2)已知斥力大小:孤电子对-孤电子对>孤电子对-成键电子对,预测
 离子的空间结构为
离子的空间结构为(3)①离子液体优异性能不断被开发利用。常见的离子液体含有如图中的离子等,已知微粒中的大
 键可以用
键可以用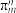 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则阳离子中的大
键中的电子数,则阳离子中的大 键可以表示为
键可以表示为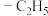 不能被H原子替换,请解释原因:
不能被H原子替换,请解释原因:
②
 也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出
也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出 的结构式
的结构式(4)为提高含氮碱性有机药物的水溶性,常用它们的盐酸盐。例如盐酸氨溴索(结构见如图)的阳离子可与水形成氢键,这些氢键表示式为O—H∙∙∙O(H2O)、

您最近一年使用:0次
解题方法
5 . 氧和硫是元素周期表中第ⅥA族元素。下列说法正确的是
| A.电负性:O<S | B.沸点: |
C. 是极性分子 是极性分子 | D. 空间构型为平面三角形 空间构型为平面三角形 |
您最近一年使用:0次
2024-04-07更新
|
235次组卷
|
2卷引用:海南省海口市2024届高三上学期摸底考试化学试卷
名校
解题方法
6 . 我国科学家最近揭示了叶片中C、N、P的化学含量以及环境调控。下列说法正确的是
A.基态原子的末成对电子数: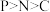 | B.电负性: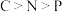 |
C.键角: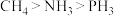 | D.第一电离能: |
您最近一年使用:0次
2022-05-31更新
|
256次组卷
|
2卷引用:海南省海口市2022届高三学生学科能力诊断(二)化学试题
7 . 冠醚是由多个二元醇分子之间失水形成的环状醚,X是其中的一种, 因其体积大小与X的空腔大小相近而恰好能进入X的环内形成超分子Y,Y中
因其体积大小与X的空腔大小相近而恰好能进入X的环内形成超分子Y,Y中 与氧原子间能形成化学键。下列说法中错误的是
与氧原子间能形成化学键。下列说法中错误的是

 因其体积大小与X的空腔大小相近而恰好能进入X的环内形成超分子Y,Y中
因其体积大小与X的空腔大小相近而恰好能进入X的环内形成超分子Y,Y中 与氧原子间能形成化学键。下列说法中错误的是
与氧原子间能形成化学键。下列说法中错误的是
| A.X可形成分子晶体 | B.Y中 与氧原子间形成的是离子键 与氧原子间形成的是离子键 |
| C.K⁺不能与X形成超分子 | D.电负性:O>C>Li |
您最近一年使用:0次
2023-04-22更新
|
250次组卷
|
2卷引用:海南省海口市2023届高三下学期4月学生学科能力诊断化学试题
8 . 我国科学家研究发现,在KOH催化下,CO(NH2)2和LiTPSI还原形成稳定的LiF/高分子双层SEI,使LiMn2O4//Li4T15O12电池稳定工作。请回答下列问题:
(1)基态Mn2+的电子排布式为[Ar]____ 。基态K原子核外电子云轮廓图呈球形的能级上占据的电子总数为____ 。
(2)Mn的第三电离能大于Fe的第三电离能的主要原因是____ 。
(3)CO(NH2)2中元素电负性由大到小的顺序为____ (用元素符号表示)。CO(NH2)2分子中碳原子的杂化方式为____ 。
(4)几种钛的卤化物的熔点如表所示:
钛的卤化物熔点呈上述变化的主要原因是____ 。
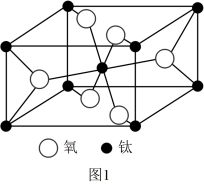
(5)一种钛的氧化物晶胞如图1所示,其化学式为____ 。
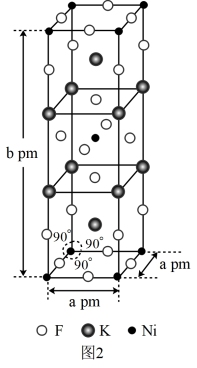
(6)由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为____ g·cm-3(只列计算式即可)。
(1)基态Mn2+的电子排布式为[Ar]
(2)Mn的第三电离能大于Fe的第三电离能的主要原因是
(3)CO(NH2)2中元素电负性由大到小的顺序为
(4)几种钛的卤化物的熔点如表所示:
| 卤化物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -25 | 39 | 150 |
(5)一种钛的氧化物晶胞如图1所示,其化学式为

(6)由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为

您最近一年使用:0次
解题方法
9 . 有W、X,Y、Z、M五种元素,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,W的单质是密度最小的气体,X、Z同主族,且Z的原子序数是X的2倍,Y是所在周期中原子半径最小的金属元素,M为金属元素,其相对原子质量是Z的2倍。回答下列问题:
(1)X、Y、Z的电负性由大到小的顺序是_______ (用元素符号表示)。
(2)五种元素中形成的二元化合物分子含18电子的有_______ (用化学式表示),写出其中一种分子的电子式:_______ 。
(3)甲为X,M元素形成的黑色化合物,甲与 ,在加热条件下生成M的单质和两种无态的物质,写出该反应的化学方程式:
,在加热条件下生成M的单质和两种无态的物质,写出该反应的化学方程式:_______ 。
(4)写出Z的+4价氧化物在酸性环境中被 氧化为Z的最高价氧化物对应的水化物的离子方程式:
氧化为Z的最高价氧化物对应的水化物的离子方程式:_______ 。
(5)电解熔融状态Y的氧化物生成Y的单质的反应中,生成2.7g固体时,收集到的气体为_______ mL(标准状况)。
(1)X、Y、Z的电负性由大到小的顺序是
(2)五种元素中形成的二元化合物分子含18电子的有
(3)甲为X,M元素形成的黑色化合物,甲与
 ,在加热条件下生成M的单质和两种无态的物质,写出该反应的化学方程式:
,在加热条件下生成M的单质和两种无态的物质,写出该反应的化学方程式:(4)写出Z的+4价氧化物在酸性环境中被
 氧化为Z的最高价氧化物对应的水化物的离子方程式:
氧化为Z的最高价氧化物对应的水化物的离子方程式:(5)电解熔融状态Y的氧化物生成Y的单质的反应中,生成2.7g固体时,收集到的气体为
您最近一年使用:0次
解题方法
10 . 短周期主族元素X、Y、Z、W的原子序数依次增大,最外层电子数满足Z=X+Y;化合物Y2X4的电子总数为18个;基态Z原子的电子总数是其最高能级电子数的2倍,且最高能级有两个未成对电子;W的氢化物水溶液及最高价氧化物对应水化物均为强酸。下列叙述错误的是
| A.X、Y、W三种元素能形成离子化合物 | B.X2Y—YX2的水溶液呈碱性 |
| C.元素的电负性:Y<Z | D.Y2Z分子中只含σ键,不含π键 |
您最近一年使用:0次
2021-02-04更新
|
438次组卷
|
3卷引用:2021年海南高考化学试题变式题1-10



