解题方法
1 . 如图甲,铜离子与有机物HA可形成一种螯合物 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
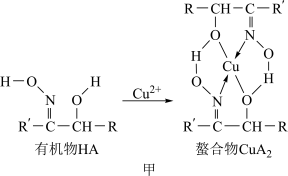
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+ CuA2+2H+
CuA2+2H+
回答下列问题:
(1)基态铜原子的价电子排布式为_______ 。
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是_______ 。
(3)螯合物 中的氮原子杂化方式为
中的氮原子杂化方式为_______ ,氧原子的杂化方式为_______ 。
(4)下列关于螯合物 的说法中,正确的是
的说法中,正确的是_______ (填序号)。
① 中O的配位能力比N强
中O的配位能力比N强
②与 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型
③ 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂
④每个 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键
(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是_______ 。
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数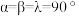 ,
, ,
,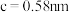 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
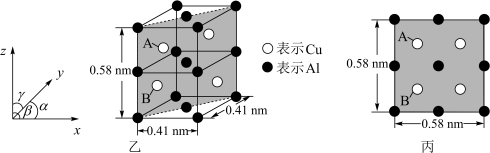
该晶体的化学式为_______ ,密度为_______  (结果保留两位有效数字)。
(结果保留两位有效数字)。
 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+
 CuA2+2H+
CuA2+2H+回答下列问题:
(1)基态铜原子的价电子排布式为
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是
(3)螯合物
 中的氮原子杂化方式为
中的氮原子杂化方式为(4)下列关于螯合物
 的说法中,正确的是
的说法中,正确的是①
 中O的配位能力比N强
中O的配位能力比N强②与
 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型③
 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂④每个
 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数
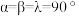 ,
, ,
,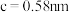 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
该晶体的化学式为
 (结果保留两位有效数字)。
(结果保留两位有效数字)。
您最近一年使用:0次
名校
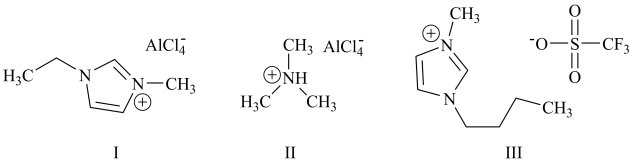
2 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________(填编号)。
(3)化合物I中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物III中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为_____ 。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为______ g·cm-3(列出计算式)。
(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为___________(填编号)。
A.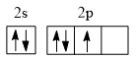 | B.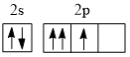 | C.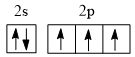 | D.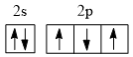 |
(4)化合物III中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。
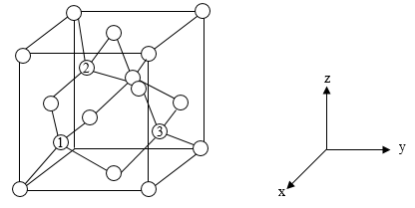
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(
 ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
2022-03-17更新
|
2774次组卷
|
10卷引用:江西省新余市2022届高三第二次模拟考试理综化学试题
江西省新余市2022届高三第二次模拟考试理综化学试题广东省广州市2022届高三一模考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国乙卷)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题(已下线)广东省广州市2022届高三一模考试(结构与性质)广东省广州市2021-2022学年高三下学期一模考试化学试题2024届四川省兴文第二中学校高三上学期一诊模拟考试理综试题(已下线)热点25 物质结构与性质综合题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
名校
3 . 乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________ 个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
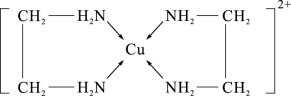
①配离子中含有的化学键类型有___________ 。
②C、N、O的第一电离能由大到小的顺序是___________ 。
③乙二胺分子中氮原子轨道的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因___________ ;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________ 是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
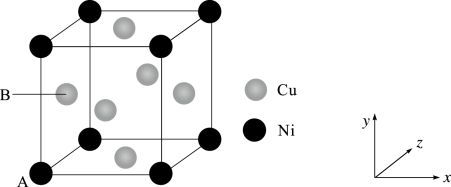
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________ 。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________ nm(列出计算式)。
(1)基态Cu原子最高能级组电子数为
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:

①配离子中含有的化学键类型有
②C、N、O的第一电离能由大到小的顺序是
③乙二胺分子中氮原子轨道的杂化类型为
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因·

(4)某镍白铜合金的立方晶胞结构如图所示。

①原子A的原子坐标为(0,0,0),原子B的原子坐标为
②若合金的密度为ρg/cm3,Ni原子之间最短距离为
您最近一年使用:0次
2021-05-07更新
|
988次组卷
|
6卷引用:江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题
江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题2022届江西省赣州市高三适应性考试(二模)理综化学试题安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)2021年山东高考化学试题变式题11-20
名校
解题方法
4 . 钯(Pd)、锌及其化合物在合成酮类物质中有极其重要的作用,如图为合成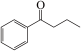 的反应过程:
的反应过程:
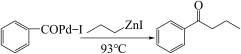
回答下列问题:
(1)I原子价电子排布式为___________ ,其能量最高的能层是___________ (填能层符号)。
(2)H、C、O三种元素的电负性由大到小的顺序为___________ 。
(3)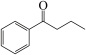 中碳原子的杂化方式为
中碳原子的杂化方式为___________ 。
(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是___________ 。
②NH3的空间构型为___________ 。
③1 mol [Zn(NH3)4]Cl2中含有___________ mol σ键。
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的___________ 。
(6)金属钯的堆积方式如图所示:
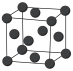
①该晶胞中原子的空间利用率为___________ (用含π的式子表示)。
②若该晶胞参数a=658 pm,则该晶胞密度为___________ (列出计算表达式)g·cm-3。
 的反应过程:
的反应过程:
回答下列问题:
(1)I原子价电子排布式为
(2)H、C、O三种元素的电负性由大到小的顺序为
(3)
 中碳原子的杂化方式为
中碳原子的杂化方式为(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是
②NH3的空间构型为
③1 mol [Zn(NH3)4]Cl2中含有
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的
(6)金属钯的堆积方式如图所示:

①该晶胞中原子的空间利用率为
②若该晶胞参数a=658 pm,则该晶胞密度为
您最近一年使用:0次
2020-04-29更新
|
313次组卷
|
4卷引用:江西省南昌市八一中学2020届高三第三次模拟理科综合化学试题
江西省南昌市八一中学2020届高三第三次模拟理科综合化学试题2020年全国高考冲刺压轴卷(样卷) 理综(全国1卷)化学试题(已下线)第十一单元 物质的结构与性质测试题-2021年高考化学一轮复习名师精讲练安徽省六安市舒城中学2019-2020学年高二下学期期末考试化学试题
解题方法
5 . GaN是制造5G芯片的材料,氮化镓和氮化铝LED可发出紫外光。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]____ 。
(2)根据元素周期律,元素的电负性Ga____ (填“大于”或“小于”,下同)As。
(3)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为____ ,其中的阴离子的空间构型为____ 。
(4)组成相似的CaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是________ 。
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为___ ;紧邻的As原子之间的距离为b,紧邻的As、Ca原子之间的距离为d,则b:d=____ ,该晶胞的密度为__ g ▪cm-3。(阿伏加 德罗常数用NA表示)

(1)基态Ga原子的核外电子排布式为[Ar]
(2)根据元素周期律,元素的电负性Ga
(3)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为
(4)组成相似的CaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为

您最近一年使用:0次
名校
解题方法
6 . (NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ 。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____ 。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(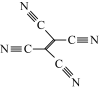 )。
)。
①CH3CN中碳原子的杂化方式是____ 和_____ 。
②TCNE中第一电离能较大的是___ (填元素符号),分子中所有原子____ (填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___ 。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为___ (列出计算式)g·cm-3。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(
 )。
)。①CH3CN中碳原子的杂化方式是
②TCNE中第一电离能较大的是
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为
您最近一年使用:0次
2020-04-06更新
|
624次组卷
|
4卷引用:江西省九江市十校2020届高三下学期模拟考试理综化学试题
江西省九江市十校2020届高三下学期模拟考试理综化学试题河南等省五岳2020届高三4月联考(全国I卷)理综化学试题河南省临颍县南街高级中学2020届高三下学期第一次月考理综化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
7 . 含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________ ,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____ 种 ,第一电离能比P大有____ 种。
(3)PH3分子的空间构型为___________ 。PH3的键角小于NH3的原因是__________ 。
(4)化合物(CH3)3N能溶于水,试解析其原因____________ 。
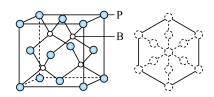
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________ ,磷原子的配位数为________ 。
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________ 。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为
(2)与P同周期的主族元素中,电负性比P小的元素有
(3)PH3分子的空间构型为
(4)化合物(CH3)3N能溶于水,试解析其原因

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑
您最近一年使用:0次
2019-02-13更新
|
2518次组卷
|
8卷引用:江西省上饶市2020届第一次高考模拟考试理科综合化学试题
江西省上饶市2020届第一次高考模拟考试理科综合化学试题【市级联考】四川省攀枝花市2019届高三上学期第二次统考化学试题【市级联考】山东省泰安市2019届高三下学期二轮模拟考试理科综合化学试题解题达人.化学选择题(2021全国卷)精编特训06(已下线)2021年高考全国甲卷化学试题变式题2020年全国卷Ⅰ理综化学高考真题变式题(已下线)2020年海南卷化学高考真题变式题15-19河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期7月份月考化学试题
名校
解题方法
8 . 图1是元素周期表的一部分,已知A、B、C、D、E、F、G都是周期表中的前四周期元素,它们在周期表中的位置如图1所示。
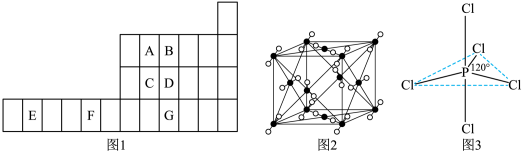
试回答下列问题:
(1)F元素基态原子的核外电子排布式为_________________ 。
(2)ABC的第一电离能由大到小的顺序______________ (用元素符号表示)。
(3)B元素单质分子中的_______ 个π键,与其互为等电子体的阴离子为____________________ 。
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用________ 杂化,每个分子周围有_____ 个分子与之距离相等且最近。若晶胞棱长为a pm,则该晶体密度的表达式为________ g·cm-3。
(5)G元素的氢化物分子的空间构型为________ ,其沸点与B元素的氢化物相比________ (填高或低),其原因是________ 。
(6)向CuSO4溶液中滴加入B 元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式________ 。
(7)知道B 的电负性大于氯,则B 与F2或Cl2形成的化合物水解,产物是否相同__________ ?(填“相同”或“不同”)。

试回答下列问题:
(1)F元素基态原子的核外电子排布式为
(2)ABC的第一电离能由大到小的顺序
(3)B元素单质分子中的
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用
(5)G元素的氢化物分子的空间构型为
(6)向CuSO4溶液中滴加入B 元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式
(7)知道B 的电负性大于氯,则B 与F2或Cl2形成的化合物水解,产物是否相同
您最近一年使用:0次
名校
解题方法
9 . 氮族元素和硼族元素在生产生活中有很重要的地位。
(1)写出硼族元素Ga的基态原子核外电子排布式_________________ 。
(2)NF3的分子构型为__________ ,NO3-的空间构型为______ ,1molNO3-中含有的σ键的数目为:_________ 。
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质。BN的晶体结构与金刚石相似,其中B原子的杂化方式________ 。
(4)元素第一电离能的大小:As______ (填“”或“=”)Ga,原因是__________ 。
(5)相同条件下,在水中的溶解度:NH3(填“”或“=”)PH3,原因是__________ 。
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为cpm。则砷化镓的化学式为________ ,晶胞中As原子和它最近的Ga原子之间的距离为_______ pm(用含c的式子表示),砷化镓的密度为_______ g/cm3(设NA为阿伏伽德罗常数的值,用含c、NA的式子表示,原子量:Ga-70,As-75)。
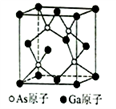
(1)写出硼族元素Ga的基态原子核外电子排布式
(2)NF3的分子构型为
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质。BN的晶体结构与金刚石相似,其中B原子的杂化方式
(4)元素第一电离能的大小:As
(5)相同条件下,在水中的溶解度:NH3(填“”或“=”)PH3,原因是
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为cpm。则砷化镓的化学式为

您最近一年使用:0次
填空题
|
较难(0.4)
|
名校
10 . 铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______ 族,其基态原子中未成对电子个数为________ 。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________ ,所含非金属元素的电负性由大到小的顺序是_____________________________ 。
(3)尿素[CO(NH2)2]分子中,碳原子为_______ 杂化,分子中σ键与π键的数目之比为_________ 。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是________________________________________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________________ 。
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________ 。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为___________________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
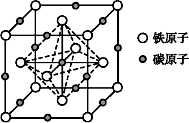
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中,碳原子为
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为

您最近一年使用:0次
2017-02-24更新
|
2505次组卷
|
11卷引用:江西省上饶市重点中学2018届高三六校第一次联考理综化学试题
江西省上饶市重点中学2018届高三六校第一次联考理综化学试题2017届安徽省A10联盟高三下学期开年考试理综化学试卷2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷吉林省实验中学2018届高三第八次月考(第四次模拟)理科综合化学试题【全国百强校】四川省棠湖中学2019届高三上学期第二次月考理科综合化学试题(已下线)2018年12月9日 《每日一题》一轮复习- 每周一测湖北省黄冈市罗田县第一中学2019届高三上学期12月月考理科综合化学试题(已下线)2019年12月8日 《每日一题》2020年高考化学一轮复习——每周一测陕西省泾干中学2021-2022学年高三上学期第一次月考化学试题2020年全国卷Ⅰ理综化学高考真题变式题广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题



