名校
1 . 下列有关说法错误的是
A. 与氢气反应生成 与氢气反应生成 时,碳的杂化方式发生变化 时,碳的杂化方式发生变化 |
B.赤血盐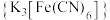 中电负性最大的是 中电负性最大的是 |
C.金刚石的晶胞为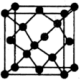 ,其俯视图为 ,其俯视图为 |
D.因为第一电离能: ,故酸性: ,故酸性: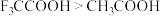 |
您最近一年使用:0次
名校
2 . 三氯甲硅烷((SiHCl₃)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8℃,熔点为-126.5℃,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:

(1)制备 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为______ ;判断制备反应结束的实验现象是______ 。图示装置存在的两处缺陷,请提出相应改进建议______ 。
(2)已知电负性Cl>H>Si, 在浓NaOH溶液中发生反应的化学方程式为
在浓NaOH溶液中发生反应的化学方程式为______ 。
(3)采用如下方法测定溶有少量HCl的 纯度。
纯度。
 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①______ ,②______ (填操作名称),③称量等操作,测得所得固体氧化物质量为 g,从下列仪器中选出①、②中需使用的仪器,依次为
g,从下列仪器中选出①、②中需使用的仪器,依次为______ (填标号)。测得样品纯度为______ (用含 、
、 的代数式表示)。
的代数式表示)。

 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
(1)制备
 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为(2)已知电负性Cl>H>Si,
 在浓NaOH溶液中发生反应的化学方程式为
在浓NaOH溶液中发生反应的化学方程式为(3)采用如下方法测定溶有少量HCl的
 纯度。
纯度。 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① g,从下列仪器中选出①、②中需使用的仪器,依次为
g,从下列仪器中选出①、②中需使用的仪器,依次为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
3 . 铜及其化合物具有广泛的应用。请回答:
(1)Cu元素位于周期表___________ 区。
(2)下列说法不正确 的是___________。
(3)高温下固体中 比
比 稳定,常温下水溶液中
稳定,常温下水溶液中 离子比
离子比 离子稳定(水溶液中
离子稳定(水溶液中 易发生歧化反应生成
易发生歧化反应生成 ),原因是
),原因是___________ 。(已知:金属阳离子在水溶液中易与水分子发生络合形成水合离子,对应的热效应称为水合能, 的水合能为
的水合能为 ,
, 的水合能为
的水合能为 ,Cu的第二电离能为
,Cu的第二电离能为 。)
。)
(4) 可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶(
可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶( )、苯酚(
)、苯酚( )含有与苯类似的
)含有与苯类似的 、
、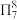 大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是
大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是___________ (填标号);1mol配合物中含配位键个数为___________ 。___________ 个。
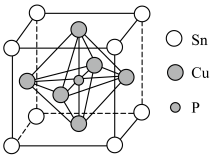
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为___________  (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
(1)Cu元素位于周期表
(2)下列说法
| A.基态铜原子的核外电子有29种不同的空间运动状态 |
B.铜催化烯烃硝化反应时会产生 , , 的键角比 的键角比 大 大 |
C. 中非金属元素电负性: 中非金属元素电负性: |
D.配位键的强度: 大于 大于 |
(3)高温下固体中
 比
比 稳定,常温下水溶液中
稳定,常温下水溶液中 离子比
离子比 离子稳定(水溶液中
离子稳定(水溶液中 易发生歧化反应生成
易发生歧化反应生成 ),原因是
),原因是 的水合能为
的水合能为 ,
, 的水合能为
的水合能为 ,Cu的第二电离能为
,Cu的第二电离能为 。)
。)(4)
 可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶(
可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶( )、苯酚(
)、苯酚( )含有与苯类似的
)含有与苯类似的 、
、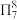 大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是
大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为
 (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
您最近一年使用:0次
2023-11-26更新
|
320次组卷
|
3卷引用:江西省上饶市婺源县天佑中学2023-2024学年高三上学期期中考试化学试卷
江西省上饶市婺源县天佑中学2023-2024学年高三上学期期中考试化学试卷浙江省9+1高中联盟2023-2024学年高三上学期期中考试化学试题 (已下线)专题04 物质结构与性质(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
4 . 化合物M由两种短周期主族元素组成,在一定条件下可以发生下列转化:
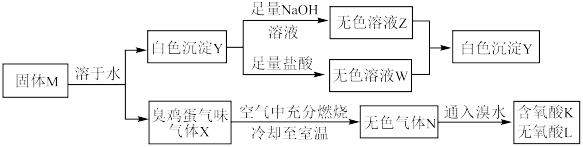
请回答下列问题:
(1)固体M的化学式为___________ 。
(2)无氧酸L中阴离子对应元素在元素周期表中的位置为___________ ,其基态原子中电子的空间运动状态有___________ 种。
(3)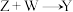 的化学方程式为
的化学方程式为___________ 。
(4)上述流程的反应中涉及的短周期非金属元素的电负性由大到小的顺序为___________ 。
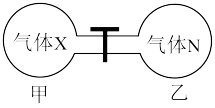
(5)如图所示,在室温下向甲、乙两相同密闭容器中,分别充入等物质的量气体X和气体N。
①反应前两容器中的气体密度: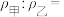
___________ 。
②打开活塞,使气体充分反应,则反应前后的压强: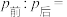
___________ 。
(6)将无色气体N通入到浓硝酸中,有红棕色气体冒出,在反应中n(氧化剂):n(还原剂)=___________ 。

请回答下列问题:
(1)固体M的化学式为
(2)无氧酸L中阴离子对应元素在元素周期表中的位置为
(3)
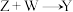 的化学方程式为
的化学方程式为(4)上述流程的反应中涉及的短周期非金属元素的电负性由大到小的顺序为
(5)如图所示,在室温下向甲、乙两相同密闭容器中,分别充入等物质的量气体X和气体N。

①反应前两容器中的气体密度:
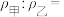
②打开活塞,使气体充分反应,则反应前后的压强:
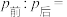
(6)将无色气体N通入到浓硝酸中,有红棕色气体冒出,在反应中n(氧化剂):n(还原剂)=
您最近一年使用:0次
2023-11-22更新
|
86次组卷
|
2卷引用:江西省赣州市部分学校联考2023-2024学年高三上学期11月期中(一轮总复习调研)化学试题
名校
5 . 第ⅢA和第ⅤA元素可形成多种化合物。请回答:
(1)基态B原子核外电子占据的最高能级符号是___________ ,基态As原子的价层电子排布式是___________ 。
(2)①固体储氢材料氨硼烷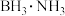 ,其结构和乙烷相似,下列有关说法正确的是
,其结构和乙烷相似,下列有关说法正确的是______ 。
A.氨硼烷中B原子的杂化方式为
B.相同条件下在水中的溶解度:氨硼烷>乙烷
C.元素B、N的第一电离能均高于相邻元素 形成的化合物中配位键的强度:
形成的化合物中配位键的强度:
________ 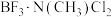 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是________ 。
(3)一种含Ga化合物晶胞如图甲,三个晶胞围成一个六棱柱,如图乙,该化合物的化学式为___________ ,每个N原子周围距离最近的N原子数目为________ 。
(1)基态B原子核外电子占据的最高能级符号是
(2)①固体储氢材料氨硼烷
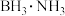 ,其结构和乙烷相似,下列有关说法正确的是
,其结构和乙烷相似,下列有关说法正确的是A.氨硼烷中B原子的杂化方式为

B.相同条件下在水中的溶解度:氨硼烷>乙烷
C.元素B、N的第一电离能均高于相邻元素
D. 是硼原子能量最低的激发态
是硼原子能量最低的激发态
 形成的化合物中配位键的强度:
形成的化合物中配位键的强度:
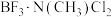 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是(3)一种含Ga化合物晶胞如图甲,三个晶胞围成一个六棱柱,如图乙,该化合物的化学式为
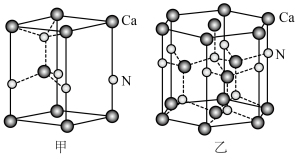
您最近一年使用:0次
2023-11-15更新
|
578次组卷
|
3卷引用:江西省抚州市黎川县第二中学2023-2024学年高三上学期11月期中化学试题
江西省抚州市黎川县第二中学2023-2024学年高三上学期11月期中化学试题浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题(已下线)专题04 物质结构与性质(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
真题
名校
6 . X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、 Y元素相邻。X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确 的是
A.第一电离能: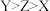 |
B.电负性: |
C.Z、W原子形成稀有气体电子构型的简单离子的半径: |
D. 与水反应生成产物之一是非极性分子 与水反应生成产物之一是非极性分子 |
您最近一年使用:0次
2023-06-21更新
|
8606次组卷
|
16卷引用:江西省宜春市百树学校2023-2024学年高三上学期11月期中考试化学试卷
江西省宜春市百树学校2023-2024学年高三上学期11月期中考试化学试卷2023年高考浙江卷化学真题(6月)(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题11-16)(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第19讲元素周期律与元素周期表(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)天津市武清区城关中学2023-2024学年高三上学期第二次阶段性练习化学试题天津市南开中学2023-2024学年高二下学期期中考试化学试卷 浙江省绍兴市诸暨市2023-2024学年高二上学期期末检测化学试题江苏省扬州中学2023-2024学年高二下学期3月考试化学试题江苏省常州市联盟校2023-2024学年高二下学期3月阶段调研化学试题
名校
解题方法
7 . 亚砷酸钠( ),易溶于水,主要用作杀虫剂、防腐剂、分析试剂等。利用
),易溶于水,主要用作杀虫剂、防腐剂、分析试剂等。利用 (分子结构如图)制备亚砷酸钠涉及以下反应:
(分子结构如图)制备亚砷酸钠涉及以下反应: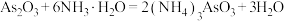 。下列说法错误的是
。下列说法错误的是
 ),易溶于水,主要用作杀虫剂、防腐剂、分析试剂等。利用
),易溶于水,主要用作杀虫剂、防腐剂、分析试剂等。利用 (分子结构如图)制备亚砷酸钠涉及以下反应:
(分子结构如图)制备亚砷酸钠涉及以下反应: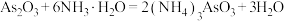 。下列说法错误的是
。下列说法错误的是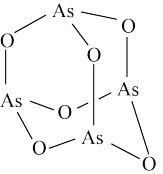
A. 的电子式为 的电子式为 |
B.砷的原子结构示意图为 |
C.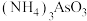 中所含元素的电负性由大到小的顺序为N>O>H>As 中所含元素的电负性由大到小的顺序为N>O>H>As |
D.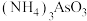 中阳离子的空间结构为正四面体形 中阳离子的空间结构为正四面体形 |
您最近一年使用:0次
2023-05-10更新
|
346次组卷
|
3卷引用:江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷
江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷 湖南省郴州市2023届高三适应性模拟考试(三模)化学试题(已下线)专题02 化学用语的正误判断-2023年高考化学真题题源解密(全国通用)
8 . 短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是
| A.X能与多种元素形成共价键 | B.简单氢化物沸点: |
C.第一电离能: | D.电负性: |
您最近一年使用:0次
2022-07-06更新
|
9237次组卷
|
28卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题
江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题(已下线)专题06 物质结构元素周期律-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)2022年辽宁高考真题化学试题(已下线)2022年辽宁省高考真题变式题(1-10)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京清华附中2022-2023学年高三上学期10月统练(三)化学试题(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题(已下线)第36讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题1-5)(已下线)题型9 元素“位—构-性”关系的综合应用-高考必备50个题型(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用) 天津市静海区第一中学2023-2024学年高三上学期12月月考化学试题天津市和平区2023-2024学年高三下学期第一次质量调查化学试卷吉林省长春外国语学校2021-2022学年高二下学期期末考试化学试题吉林省长春市第五中学2022-2023学年高二上学期期末考试化学试题河南省鹤壁市高中2022-2023学年高二下学期第一次段考化学试题天津市和平区2022-2023学年高二下学期期末质量调查化学试题天津市第一中学2022-2023学年高二上学期期末考试化学试题河北省遵化市第一中学2023-2024学年高二上学期月考2化学试题吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题内蒙古呼和浩特市剑桥中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
9 . 由于铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,受到研究人员的广泛关注。γˊ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去___________ 轨道电子,Fe3+价层电子排布图为___________ 。
(2)氨气中N的杂化类型是___________ ,NH3中H−N−H的键角比NH4+中H−N−H的键角___________ (填“大”或“小”),理由是___________ 。
(3) 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有___________ (填标号)。
A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是___________ ,配位原子为___________ 。
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为___________ 。
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为___________ 。已知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为___________ nm(用含d和NA的代数式表示)。
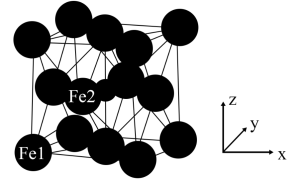
(1)Fe变为Fe2+时是失去
(2)氨气中N的杂化类型是
(3)
 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
2021-12-31更新
|
288次组卷
|
5卷引用:江西稳派2022-2023学年高三上学期期中联考化学试题
10 . 三硫化四磷是黄绿色针状结晶,其结构如图所示。不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:
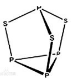
(1)Se是S的下一周期同主族元素,其核外电子排布式为_____ 。
(2)第一电离能:S_____ (填“>”或“<”,下同)P,电负性:S_____ P
(3)三硫化四磷分子中P原子采取_____ 杂化,与PO 互为等电子体的化合物分子的化学式为
互为等电子体的化合物分子的化学式为_______ 。
(4)二硫化碳属_______ (填“极性”或“非极性”)分子。
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_______ 。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是_______ 。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为acm ,晶胞中Na+的配位数为_______ ,用NA表示阿伏加德罗常数的数值,NaOH的密度为_______ g/cm3.

(1)Se是S的下一周期同主族元素,其核外电子排布式为
(2)第一电离能:S
(3)三硫化四磷分子中P原子采取
 互为等电子体的化合物分子的化学式为
互为等电子体的化合物分子的化学式为(4)二硫化碳属
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为acm ,晶胞中Na+的配位数为
您最近一年使用:0次
2016-12-09更新
|
754次组卷
|
10卷引用:2017届江西省赣州市十四县(市)高三下学期期中联考理综化学试卷
2017届江西省赣州市十四县(市)高三下学期期中联考理综化学试卷江西省赣中南五校2017届高三下学期期中联合考试化学试题2016届山西省临汾一中高三下3月月考理综化学试卷广西南宁市2017届高三第一次模拟测试理综化学试题2017届广西钦州市高三下学期普通高中毕业班第一次适应性测试(二模)理综化学试卷广西陆川县中学2018届高三9月月考理科综合化学试题辽宁省丹东市2018届高三一模考试理综-化学试题(已下线)广西钦州市普通高中2017届高三下学期第一次适应性测试(二模)理综化学试题(已下线)易错28 晶胞的结构与性质-备战2021年高考化学一轮复习易错题(已下线)第5周 周测卷-备战2022年高考化学周测与晚练(新高考专用)



