2023·山东·高考真题
真题
解题方法
1 . 三氯甲硅烷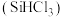 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为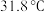 ,熔点为
,熔点为 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
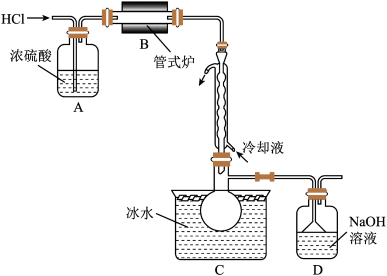
(1)制备 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为_____ ;判断制备反应结束的实验现象是_____ 。图示装置存在的两处缺陷是_____ 。
(2)已知电负性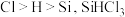 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为_____ 。
(3)采用如下方法测定溶有少量 的
的 纯度。
纯度。
 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①_____ ,②_____ (填操作名称),③称量等操作,测得所得固体氧化物质量为 ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为_____ (填标号)。测得样品纯度为_____ (用含 、
、 的代数式表示)。
的代数式表示)。

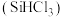 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为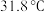 ,熔点为
,熔点为 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
(1)制备
 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为(2)已知电负性
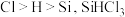 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为(3)采用如下方法测定溶有少量
 的
的 纯度。
纯度。 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-06-19更新
|
10730次组卷
|
16卷引用:T26-工业流程题
(已下线)T26-工业流程题(已下线)2023年高考山东卷化学真题变式题(实验综合题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点12 硅及其无机非金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第10讲 硅及其化合物(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点13 硅及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2023年高考山东卷化学真题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)2024届河北省实验中学高三年级上学期第一次月考化学试题
2022·北京海淀·一模
名校
2 . 某科研团队研究用不同金属氧化物催化肉桂醛制苯甲醛(反应如下,部分产物略去)。反应时间和其它条件相同时,测得实验数据如下表。
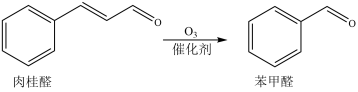
已知:i.选择性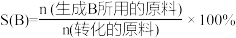
ii. 与
与 同主族。
同主族。
下列说法不正确 的是

| 催化剂 | 金属元素的电负性 | 肉桂醛转化率/% | 苯甲醛选择性/% |
 | 0.9 | 80.79 | 71.93 |
 | 1.0 | 78.27 | 60.51 |
 | 1.5 | 74.21 | 54.83 |
 | 1.6 | 76.46 | 48.57 |
 | 1.9 | 75.34 | 41.71 |
ii.
 与
与 同主族。
同主族。下列说法
| A.肉桂醛制苯甲醛的反应属于氧化反应 |
B.用 作催化剂可以获得比用 作催化剂可以获得比用 更大的主反应速率 更大的主反应速率 |
C.使用 作催化剂时,反应后副产物最多 作催化剂时,反应后副产物最多 |
| D.金属氧化物中金属元素的电负性越小,苯甲醛选择性越好 |
您最近一年使用:0次
2022-04-01更新
|
650次组卷
|
5卷引用:北京市海淀区2022届高三一模(选择题6-10)
2023·北京石景山·模拟预测
名校
解题方法
3 . 碘及其化合物在生产、生活中有着广泛的应用。回答下列问题:
电负性:H 2.20;C 2.55;F 3.98;P 2.19;I 2.66
(1)人工合成的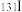 是医疗上常用的放射性同位素,碘在周期表中的位置是
是医疗上常用的放射性同位素,碘在周期表中的位置是_______ 。
(2)碘单质在 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因_______ 。
(3)HI主要用于药物合成,通常用 和P反应生成
和P反应生成 ,
, 再水解制备HI.
再水解制备HI. 的空间结构是
的空间结构是_______ , 水解生成HI的化学方程式是
水解生成HI的化学方程式是_______ 。
(4) 是一种甲基化试剂,
是一种甲基化试剂, 可用作制冷剂,
可用作制冷剂, 和
和 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: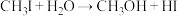 和
和 。
。 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因_______ 。
(5) 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
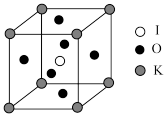
①与K原子紧邻的O原子有_______ 个。
② 的摩尔质量为214g/mol,阿伏加德罗常数为
的摩尔质量为214g/mol,阿伏加德罗常数为 。该晶体的密度是
。该晶体的密度是_______ 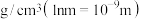 。
。
电负性:H 2.20;C 2.55;F 3.98;P 2.19;I 2.66
(1)人工合成的
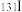 是医疗上常用的放射性同位素,碘在周期表中的位置是
是医疗上常用的放射性同位素,碘在周期表中的位置是(2)碘单质在
 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因(3)HI主要用于药物合成,通常用
 和P反应生成
和P反应生成 ,
, 再水解制备HI.
再水解制备HI. 的空间结构是
的空间结构是 水解生成HI的化学方程式是
水解生成HI的化学方程式是(4)
 是一种甲基化试剂,
是一种甲基化试剂, 可用作制冷剂,
可用作制冷剂, 和
和 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: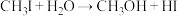 和
和 。
。 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因(5)
 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
①与K原子紧邻的O原子有
②
 的摩尔质量为214g/mol,阿伏加德罗常数为
的摩尔质量为214g/mol,阿伏加德罗常数为 。该晶体的密度是
。该晶体的密度是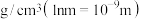 。
。
您最近一年使用:0次
2023-03-17更新
|
623次组卷
|
6卷引用:专题17 结构与性质
21-22高三上·湖北·期中
解题方法
4 . 下列有关化学用语表述或性质比较正确的是
A.基态氧原子核外价电子排布轨道表示式 |
| B.基态氧原子核外有8种空间运动状态的电子 |
C.用原子轨道描述氢分子中化学键的形成: |
| D.第三周期的元素中,第一电离能介于Mg和S之间只有1种元素 |
您最近一年使用:0次
22-23高二上·湖北荆州·期末
5 . 2022年诺贝尔化学奖授予开发“点击化学”科学家。分子R称为“点击化学试剂”,如图所示。下列叙述错误的是
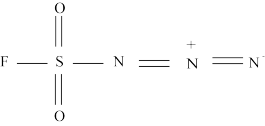
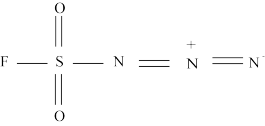
A.电负性: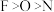 |
B.第一电离能: |
| C.S原子核外有6种运动状态不同的电子 |
| D.基态F原子核外电子占据3个能级 |
您最近一年使用:0次
2023-01-04更新
|
400次组卷
|
3卷引用:北京市海淀区2023届高三上学期期末考试变式汇编(8-14)
(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(8-14)湖北省荆州市八县市2022-2023学年高二上学期期末联考化学试题福建省泉州市三校2022-2023学年高二下学期4月期中联考化学试题
22-23高二上·四川内江·阶段练习
名校
6 . 化学上存在许多的递变关系,下列递变关系完全正确的是
A.熔沸点 ;硬度: ;硬度: |
B.稳定性: ;沸点: ;沸点: |
C.酸性: ;非金属性: ;非金属性: |
D.第一电离能: ;电负性: ;电负性: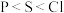 |
您最近一年使用:0次
2022-11-18更新
|
809次组卷
|
4卷引用:北京市海淀区2023届高三上学期期末考试变式汇编(1-7)
22-23高二下·山西太原·阶段练习
名校
解题方法
7 . 下列对分子性质的解释中,错误的是
A. 易溶于水是因为 易溶于水是因为 是极性分子,溶剂水也是极性分子 是极性分子,溶剂水也是极性分子 |
B.由于乳酸(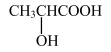 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 |
C.水很稳定( 以上才会部分分解)是因为水分子间存在大量的氢键 以上才会部分分解)是因为水分子间存在大量的氢键 |
D.酸性: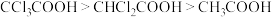 是因为 是因为 原子电负性大,使得羟基 原子电负性大,使得羟基 键极性增强,易电离出 键极性增强,易电离出 |
您最近一年使用:0次
2023-04-01更新
|
339次组卷
|
3卷引用:2023年北京卷高考真题变式题(选择题6-10)
2022·北京房山·二模
解题方法
8 . 金属铬及其化合物广泛应用于工业生产中。
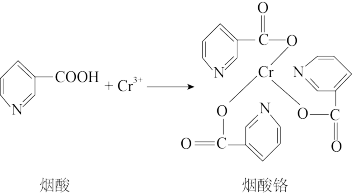
(1)烟酸铬是铬的一种化合物,可促进生物体内的蛋白质合成,提高生物体的免疫力,其合成过程如图:
①H、C、N、O的电负性由大到小的顺序是____ 。
②烟酸中碳原子的杂化方式为____ 。
(2)基态铬原子的核外电子排布式为____ ,有____ 个未成对电子。
(3)铬元素的一种配合物[Cr(H2O)4Cl2]Cl•2H2O,配离子中提供孤电子对的原子为____ ,配位数为____ 。
(4)Cr2O3晶体的熔点为2435℃,而CrCl3晶体易升华,其主要原因是____ 。
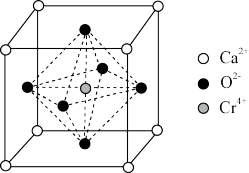
(5)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。该晶体的化学式为____ 。
(1)烟酸铬是铬的一种化合物,可促进生物体内的蛋白质合成,提高生物体的免疫力,其合成过程如图:

①H、C、N、O的电负性由大到小的顺序是
②烟酸中碳原子的杂化方式为
(2)基态铬原子的核外电子排布式为
(3)铬元素的一种配合物[Cr(H2O)4Cl2]Cl•2H2O,配离子中提供孤电子对的原子为
(4)Cr2O3晶体的熔点为2435℃,而CrCl3晶体易升华,其主要原因是
(5)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。该晶体的化学式为

您最近一年使用:0次
2022·北京西城·模拟预测
名校
解题方法
9 . 螯合树脂吸附法处理废水具有吸附容量大、速度快以及选择性好等特点,已成为近年来的研究热点。螯合树脂M与Cu2+形成新的螯合物Q,从而达到去除Cu2+的效果,吸附机理如图所示。

资料:
①吸附原理
螯合树脂M中的—OH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)基态Cu的价层电子排布的轨道表示式是____ 。
(2)M中四种元素电负性由大到小的顺序为(用元素符号表示)____ 。
(3)M中N原子的杂化轨道类型为____ 。
(4)Q中存在配位键,其中提供空轨道的是____ 。
(5)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量(Qe)有影响,实验结果如图所示。
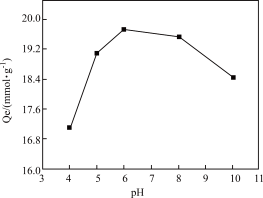
①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为____ 时吸附效果最好。
②从平衡移动角度解释,体系碱性过强时,吸附能力下降的原因____ 。
③从结构角度解释:体系酸性较强时,吸附能力下降的原因____ 。

资料:
①吸附原理
螯合树脂M中的—OH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)基态Cu的价层电子排布的轨道表示式是
(2)M中四种元素电负性由大到小的顺序为(用元素符号表示)
(3)M中N原子的杂化轨道类型为
(4)Q中存在配位键,其中提供空轨道的是
(5)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量(Qe)有影响,实验结果如图所示。

①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为
②从平衡移动角度解释,体系碱性过强时,吸附能力下降的原因
③从结构角度解释:体系酸性较强时,吸附能力下降的原因
您最近一年使用:0次
2023·北京东城·模拟预测
名校
解题方法
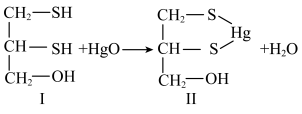
10 . 重金属元素具有毒性,常用含巯基(-SH)的有机化合物作为解毒剂。例如,解毒剂化合物I与氧化汞生成化合物II。
(1)汞的原子序数为80,位于元素周期表第___________ 周期第IIB族。
(2)基态硫原子价电子排布式为___________ 。
(3)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(4)化合物III也是一种汞解毒剂。下列说法正确的是___________。

(5)理论预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
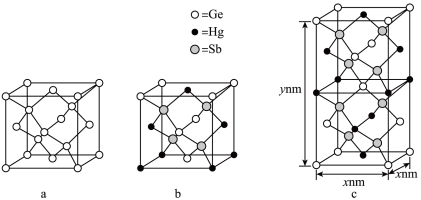
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是___________ 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_______ ;该晶胞中粒子个数比Hg:Ge:Sb = _______ 。
③设X的最简式的式量为M,阿伏加德罗常数为NA.则X晶体的密度为______ g/cm3(列出算式)。

(1)汞的原子序数为80,位于元素周期表第
(2)基态硫原子价电子排布式为
(3)H2S、CH4、H2O的沸点由高到低顺序为
(4)化合物III也是一种汞解毒剂。下列说法正确的是___________。

| A.在I中,O和S原子都采取sp3杂化 |
| B.在II中S元素的电负性最大,更易与Hg结合成键 |
| C.在III中,C-C-C键角是180° |
| D.与化合物I相比,III的水溶性更好 |

①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
③设X的最简式的式量为M,阿伏加德罗常数为NA.则X晶体的密度为
您最近一年使用:0次



