1 . 氢能的存储是其应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________ ,该能层具有的原子轨道数为________ 。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是
2NH3实现储氢和输氢。下列说法正确的是( )
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是___________ 。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2
 2NH3实现储氢和输氢。下列说法正确的是
2NH3实现储氢和输氢。下列说法正确的是| A.NH3分子中氮原子的轨道杂化方式为sp2杂化 |
| B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体 |
| C.相同压强下,NH3沸点比PH3的沸点高 |
| D.[Cu(NH3)4]2+中,N原子是配位原子 |
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是
您最近一年使用:0次
2 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A与B同周期、A与D同族,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)E原子核外电子排布式是_____________ 。
(2)B的最高价含氧酸根的空间构型为__________________ 。
(3)A、B、D三种元素电负性由大到小排列顺序为____________ 。
(4)D单质比化合物DA的熔点____ (填“高”或“低”),理由是_______________ 。
(5)已知A、C和地壳中含量最多的元素按1∶1∶2的原子个数比可形成某离子化合物,该化合物能使酸性高锰酸钾溶液褪色,写出发生反应的离子方程式___________________________ 。
(1)E原子核外电子排布式是
(2)B的最高价含氧酸根的空间构型为
(3)A、B、D三种元素电负性由大到小排列顺序为
(4)D单质比化合物DA的熔点
(5)已知A、C和地壳中含量最多的元素按1∶1∶2的原子个数比可形成某离子化合物,该化合物能使酸性高锰酸钾溶液褪色,写出发生反应的离子方程式
您最近一年使用:0次
2016-12-09更新
|
172次组卷
|
2卷引用:2015届四川省资阳市高三第三次模拟考试理综化学试卷
2013·河北邯郸·二模
3 . 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为2Al(OH)3+12HF+3A =2Na3AlFs+3CO2+9H2O。
(1)熔融晶体A时痛要破坏的作用力是_______ ,冰晶石中的配位体是______ 。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为________________ ,该分子的空间构型为___________ 。
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小:____________ ;写出含有其中电负性较小元素的原子,且形成的分子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种)_______________ 、________________ 。
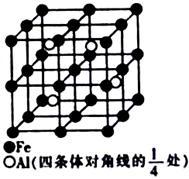
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为_________ 。若晶胞的边长为a nm,则合金的密度为______ g• cm-3。
(1)熔融晶体A时痛要破坏的作用力是
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小:
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为

您最近一年使用:0次
2012·陕西·一模
4 . C、Si、S和N元素在化学中占有极其重要的地位。
(1)写出Si的基态原子价电子排布式______ 。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为______ 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为______ ,微粒间存在的作用力是______ 。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是______ 。
(4)SO2、NO2、H2S同属于______ 结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是______ 。
(1)写出Si的基态原子价电子排布式
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是
(4)SO2、NO2、H2S同属于
您最近一年使用:0次
2012·河南焦作·一模
5 . (15分) 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出元素O的基态原子电子排布式_____________ 。
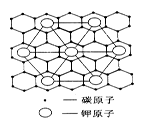
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图,则x值为_____ 。
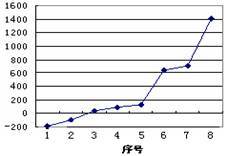
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表________ (填元素符号);其中电负性最大的是___________ (填图中的序号)。
(4)由i原子跟d原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为__________ ,d原子的杂化类型为_______ 。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
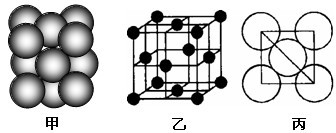
若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,
则该晶体的密度为__________________ g/cm3(用字母表示)。
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
试回答下列问题:
(1)请写出元素O的基态原子电子排布式
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图,则x值为

(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表

(4)由i原子跟d原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,
则该晶体的密度为
您最近一年使用:0次



