名校
解题方法
1 . 黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图A),晶胞参数a=3.310A,b=4.380A,c=10.500A。黑磷烯是二维的单层黑磷(图B),黑磷烯与石墨烯结构相似,P的配位数为3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷结构中只有一种等效的三配位P,所有P原子的成键环境一样,图A中编号为①的P原子的晶胞内坐标为(0.50,0.090,0.598)。请回答下列问题:
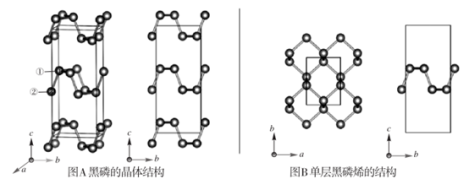
(1)写出P原子的价电子排布:___ 。
(2)P和F的电负性大小顺序是X(P)___ X(F)。(填“<”“=”或“>”)P和F形成的分子PF3和PF5,它们的几何构型分别为__ 、__ 。
(3)①黑磷中P原子杂化类型是__ 。黑磷中不存在__ (选填字母序号)。
A.共价键 B.σ键 C.π键 D.范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为__ ,原因是__ 。
(4)图A中编号为②的P原子的晶胞内坐标为__ ,黑磷的晶胞中含有__ 个P原子。

(1)写出P原子的价电子排布:
(2)P和F的电负性大小顺序是X(P)
(3)①黑磷中P原子杂化类型是
A.共价键 B.σ键 C.π键 D.范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为
(4)图A中编号为②的P原子的晶胞内坐标为
您最近一年使用:0次
2020-07-13更新
|
233次组卷
|
2卷引用:江西省吉安、抚州、赣州市2020届高三一模理科综合化学试题
2 . 铁及其化合物在生产、生活中有广泛应用。
(1)铁原子核外有__________ 种运动状态不同的电子,Fe3+基态核外电子排布式为_______________ 。
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为________ (用元素符号表示),CN-中σ键与π键的数目比n(σ)∶n(π)=__________ ;HCN中C原子轨道的杂化类型为__________ 。HCN的沸点为25.7℃,既远大于N2的沸点(-195.8℃)也大于HCl的沸点(-85℃)的原因是__________ 。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为________ ,其中Fe的配位数为_____________ 。
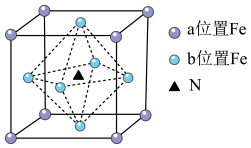
(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0, ,
, )、(
)、( ,0,
,0, )和(
)和( ,
, ,0),则a位置Fe原子和N原子的坐标分别为
,0),则a位置Fe原子和N原子的坐标分别为__________ 、__________ 。N与Fe原子之间最短距离a pm。设阿伏加 德罗常数的值为NA,则该铁氮化合物的密度是__________ g·cm-3(列出计算表达式)。
(1)铁原子核外有
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为

(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0,
 ,
, )、(
)、( ,0,
,0, )和(
)和( ,
, ,0),则a位置Fe原子和N原子的坐标分别为
,0),则a位置Fe原子和N原子的坐标分别为
您最近一年使用:0次
3 . 硅、硼、铜、硒的单质及化合物在现代工业生产中有着广泛应用。回答下列问题:
(1)基态Cu+的核外价层电子排布式为_______________ ;Be、B、Al的第一电离能由大到小的顺序是______________________________ 。
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se___ Si(填“>”、“<”)。
(3)SeO32-中Se原子的杂化类型为______ ,与其互为等电子体的一种分子的分子式是______________ 。
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为_________ ,Cu(NO3)2中的化学键除了σ键外,还存在_______________ 。
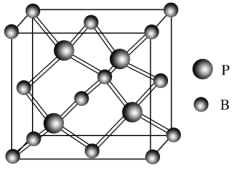
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为___________ ,已知该晶体的晶胞参数a pm,用NA代表阿伏伽德罗常数的值,则该晶体的密度为____ g·cm-3;构成晶体的两种粒子之间的最近距离为__________ pm。
(1)基态Cu+的核外价层电子排布式为
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
(3)SeO32-中Se原子的杂化类型为
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为

您最近一年使用:0次
名校
解题方法
4 . 1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______ 族
(2)下列关于Ge元素叙述正确的是______ (从下列选项中选择)
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________
(4)NH3也常作制冷剂,其键角_______ (填“大于”或“小于”)109°28′,NH3的沸点(239.6 K)高于N2沸点的主要原因是___________________________
(5)图示材料的理想化学式(无空位时)为___________________ ,若Y(钇)元素的化合价为+3,则Cu的平均化合价为_______

(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为________ (只含一个系数,用a、ρ、NA表示)。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于
(2)下列关于Ge元素叙述正确的是
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是
(4)NH3也常作制冷剂,其键角
(5)图示材料的理想化学式(无空位时)为

(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为
您最近一年使用:0次
名校
5 . Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________ ,M2+的核外电子排布式为________________________ 。
(2)M2Z的熔点比M2W的_________ (填“高”或“低”) ,请解释原因___________ 。
(3)N3-和YZ2是等电子体,则N3-的结构式为_________________ 。
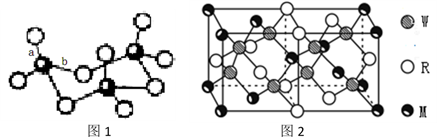
(4)WZ2分子中W原子价层电子对数是_____________ 对,WZ2的VSEPR 模型名称为______________________ ,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________ ;WZ3的三聚体环状结构如图1所示,该结构中W原子的杂化轨道类型为__________ ;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________ (填图2中字母) ,该分子中含有___ 个σ键。
(5)MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与_______ 个W原子相连,晶体密度ρ=_______ g/cm3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA=6.02×1023mol-1)。
| 元素 | 相关信息 |
| Y | 原子核外有6个不同运动状态的电子 |
| Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
| W | 主族元素,与Z原子的价电子数相同 |
| R | 价层电子排布式为3d64s2 |
| M | IB族,其被称作“电器工业的主角” |
(1)Z、W元素相比,第一电离能较大的是
(2)M2Z的熔点比M2W的
(3)N3-和YZ2是等电子体,则N3-的结构式为
(4)WZ2分子中W原子价层电子对数是

(5)MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与
您最近一年使用:0次
名校
6 . 向硫酸铜水溶液中逐滴滴加氨水,先生成蓝色沉淀,继续滴加氨水得到深蓝色溶液,再向溶液中加入乙醇,有深蓝色晶体[Cu(NH3)4]SO4·H2O析出。
(1)铜元素位于元素周期表中____ 区,高温超导体钇钡铜氧材料中铜元素有+2和+3两种价态,基态Cu3+的电子排布式为____ 。
(2)非金属元素N、O、S的第一电离能由大到小的顺序是____ (用元素符号表示)。
(3)上述深蓝色晶体中含有的元素的电负性最小的是____ (用元素符号表示)。
(4)H2O的中心原子轨道杂化类型为____ 杂化;SO42-离子的立体构型是____ ,写出与SO42-互为等电子体的一种离子____ 。
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因____ 。
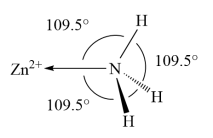
(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7 pm,阿伏加 德罗常数的值取6.02×1023,则重冰的密度为____ g.cm-3(只列式,不计算)。
(1)铜元素位于元素周期表中
(2)非金属元素N、O、S的第一电离能由大到小的顺序是
(3)上述深蓝色晶体中含有的元素的电负性最小的是
(4)H2O的中心原子轨道杂化类型为
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因

(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7 pm,阿伏加 德罗常数的值取6.02×1023,则重冰的密度为

您最近一年使用:0次
2019-11-13更新
|
289次组卷
|
3卷引用:2019年四川省遂宁市高三零诊考试理综化学试题
名校
7 . 锰及其化合物用途非常广泛。回答下列问题:
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是___________ 。
(2)基态Mn原子的价电子排布式为_________ ,未成对电子数为_____ 个。
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是____________ 。
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为________ 。
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_____ ,该分子中碳原子的杂化方式为_______ ;C、H、N的电负性从大到小的顺序为________ 。
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是_________ 。
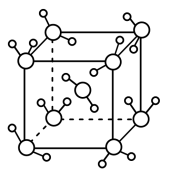
(6)某种含锰特殊材料的晶胞结构如下图所示:
若晶胞参数为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为____ ( 列出代数式即可)。
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是
(2)基态Mn原子的价电子排布式为
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是
(6)某种含锰特殊材料的晶胞结构如下图所示:

若晶胞参数为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为
您最近一年使用:0次
2018-05-17更新
|
388次组卷
|
2卷引用:【全国市级联考】河南省安阳市2018届高三第三次模拟考试理综化学试题
8 . 我国考古人员在秦陵挖掘的宝剑,到现们还是锋利无比,原因是剑锋上面覆盖了一层铬。
(1)写出Cr的外围电子排布式_______ 。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________ 。
(2)根据下表Cr原子的能级电离能(I:k]/mol)数据,解释原子逐级电离能增大的原因:_______ 。
(2)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的[Cr(H2O)4C12]Cl·6H2O和紫色的______ ,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,则NH3的VSEPR模型为_____ ,N的杂化方式为________ ,写出NH3的一种等电子体___________ 。
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是___________ 。
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是__________
A.Na B.Po C.Mg D.Cu
②晶胞中Cr的配位数为_________
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏伽德罗常数用NA表示,则Cr的原子半径是__ pm.(写出表达式即可)
(1)写出Cr的外围电子排布式
(2)根据下表Cr原子的能级电离能(I:k]/mol)数据,解释原子逐级电离能增大的原因:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是
A.Na B.Po C.Mg D.Cu
②晶胞中Cr的配位数为
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏伽德罗常数用NA表示,则Cr的原子半径是
您最近一年使用:0次
名校
解题方法
9 . 新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____ ,该能层具有的原子轨道数为_____ .
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____ ,B原子的杂化轨道类型是_____ .
Li、B、H元素的电负性由大到小排列顺序为_____ .
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____ H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是_____ (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____ ,NaH的理论密度是___________ g•cm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是
Li、B、H元素的电负性由大到小排列顺序为
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+
| I1/kJ•mol﹣1 | I2/kJ•mol﹣1 | I3/kJ•mol﹣1 | I4/kJ•mol﹣1 | I5/kJ•mol﹣1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为
您最近一年使用:0次
2016-12-09更新
|
390次组卷
|
7卷引用:2016届山东省邹城一中高三下学期4月模拟考试理科综合化学试卷
10 . 工业上常利用铜萃取剂,使溶液中的Cu2+富集进入有机相,再经过进一步的反萃取实现金属铜的沉积、再生,铜萃取剂富集Cu2+的原理如下:
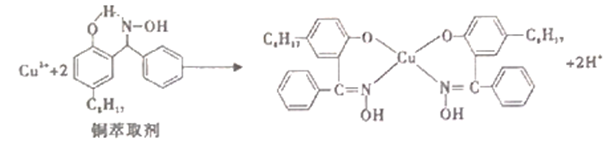
(1)基态铜原子所失去的第一个电子所占据的能层符号是______ , 价铜离 子的简化电子排布式为_________ 。
(2)铜萃取剂中所含 元素的电负性由大到小顺序为______ ,N原子以_____ 杂化轨道与O原子形成σ键。
(3)铜萃取剂与 Cu2+形成的配合物在水相的溶解度______ 有机相的溶解度(填“>”、“<”、“=”),该配合物晶体类型为_____ 。
(4)某学生用硫酸铜溶液与氨水做了一组实 验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式
沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式_________ ;沉淀溶解后溶液中的阳离子内存在的化学键类型有________ 。
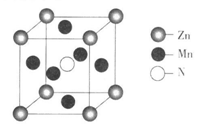
(5)铜的一种氯化物的晶胞如图所示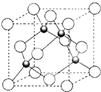 ,该氯化物的化学式
,该氯化物的化学式_____ ,Cu 和Cl之间最短距离为460.0pm,则晶体密度为______ g/cm3。(列式表示)

(1)基态铜原子所失去的第一个电子所占据的能层符号是
(2)铜萃取剂中所含 元素的电负性由大到小顺序为
(3)铜萃取剂与 Cu2+形成的配合物在水相的溶解度
(4)某学生用硫酸铜溶液与氨水做了一组实 验:CuSO4溶液
 蓝色沉淀
蓝色沉淀 沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式
沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式(5)铜的一种氯化物的晶胞如图所示
 ,该氯化物的化学式
,该氯化物的化学式
您最近一年使用:0次



