2024·天津·一模
名校
解题方法
1 . 钛被誉为太空金属和亲生物金属,拥有卓越的金属特性。它在特定温度下能与多种物质发生反应,在生产和日常生活中都能找到它的踪影。______ ,基态Ti原子的价电子占据原子轨道数目是______ 。
(2) 熔点是
熔点是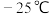 ,沸点136.4℃,可溶于苯或
,沸点136.4℃,可溶于苯或 ,该晶体属于
,该晶体属于______ 晶体; 的制备是以单质Ti和
的制备是以单质Ti和 通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式
通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式______ ;以 为原料制备
为原料制备 的原理为
的原理为______ (用化学方程式表示)。
(3)已知TiC在碳化物中硬度最大,工业上一般在真空和高温 条件下用C还原
条件下用C还原 制取
制取 。该反应中涉及的元素按电负性由大到小的顺序排列为
。该反应中涉及的元素按电负性由大到小的顺序排列为______ 。
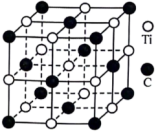
(4)利用钛粉和碳粉反应可生成碳化钛,它在刀具制造领域有重要应用。在该晶体中Ti原子周围紧邻的Ti原子数目为______ 个;设 为阿伏加德罗常数的值,若晶胞边长为
为阿伏加德罗常数的值,若晶胞边长为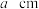 ,则晶体的密度为
,则晶体的密度为______  。(写出表达式)
。(写出表达式)
(2)
 熔点是
熔点是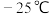 ,沸点136.4℃,可溶于苯或
,沸点136.4℃,可溶于苯或 ,该晶体属于
,该晶体属于 的制备是以单质Ti和
的制备是以单质Ti和 通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式
通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式 为原料制备
为原料制备 的原理为
的原理为(3)已知TiC在碳化物中硬度最大,工业上一般在真空和高温
 条件下用C还原
条件下用C还原 制取
制取 。该反应中涉及的元素按电负性由大到小的顺序排列为
。该反应中涉及的元素按电负性由大到小的顺序排列为(4)利用钛粉和碳粉反应可生成碳化钛,它在刀具制造领域有重要应用。在该晶体中Ti原子周围紧邻的Ti原子数目为
 为阿伏加德罗常数的值,若晶胞边长为
为阿伏加德罗常数的值,若晶胞边长为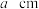 ,则晶体的密度为
,则晶体的密度为 。(写出表达式)
。(写出表达式)
您最近一年使用:0次
2023高三·全国·专题练习
2 . 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是_______ 。根据对角线规则,B的一些化学性质与元素_______ 的相似。
(2)NH3BH3分子中,N—B化学键称为_______ 键,其电子对由_______ 提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH +B3O
+B3O +9H2。B3O
+9H2。B3O 的结构为
的结构为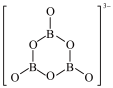 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由_______ 变为_______ 。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是_______ 。
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
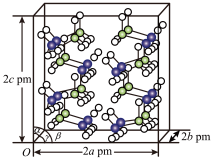
氨硼烷晶体的密度ρ=_______ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)H、B、N中,原子半径最大的是
(2)NH3BH3分子中,N—B化学键称为
 +B3O
+B3O +9H2。B3O
+9H2。B3O 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。

氨硼烷晶体的密度ρ=
您最近一年使用:0次
2023高三·全国·专题练习
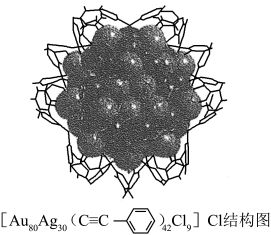
3 . 腐蚀、防腐以及催化等化学化工过程都涉及金属纳米团簇的研究,团簇已经成为化学和材料研究的前沿和热点。金属纳米团簇最外层需要配体来稳定,常见有硫醇配体、磷配体和炔配体。卤素作为第二配体或第三配体,其体积比硫醇配体、磷配体和炔配体更小,在形成纳米团簇的过程中空间位阻更小,而且卤素与金、银具有较好的配位能力。
(1)银位于元素周期表第五周期第ⅠB族元素,其价电子排布式为______ 。
(2)金(Au)溶于王水的原理是金与强氧化性的硝酸生成微量的Au3+和NO,盐酸提供的Cl-与Au3+形成[AuCl4]-配离子,写出总反应的离子方程式:______ 。
(3)[Au80Ag30(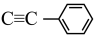 )42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是
)42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是______ 。
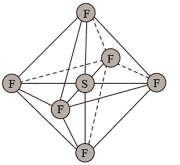
(4)第三周期部分主族元素的氟化物的熔点(见表)。
由表中数值可以判断AlF3晶体类型为_______ ,SiF4比SF6熔点低的原因______ ;SF6分子的空间构型为正八面体,如图所示,该分子的键角分别为______ ,它的二氯代物SF4Cl2有______ 种。
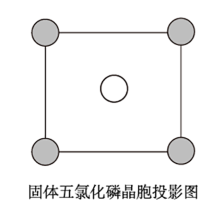
(5)固态五氯化磷为离子晶体,结构单元可以写作PCl 、PCl
、PCl ,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:
,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:______ ,若密度为dg/cm3,则晶胞参数a=_______ cm(已知阿伏加德罗常数的值为NA,列出计算式即可)
(1)银位于元素周期表第五周期第ⅠB族元素,其价电子排布式为
(2)金(Au)溶于王水的原理是金与强氧化性的硝酸生成微量的Au3+和NO,盐酸提供的Cl-与Au3+形成[AuCl4]-配离子,写出总反应的离子方程式:
(3)[Au80Ag30(
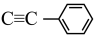 )42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是
)42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是
(4)第三周期部分主族元素的氟化物的熔点(见表)。
| 化合物 | NaF | AlF3 | SiF4 | SF6 |
| 熔点/℃ | 993 | 1040 | -90 | -50.5 |

(5)固态五氯化磷为离子晶体,结构单元可以写作PCl
 、PCl
、PCl ,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:
,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:
您最近一年使用:0次
2023·陕西·模拟预测
名校
4 . 铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:
(1)基态铁原子中,价电子电子云的伸展方向有_______ 种。
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有_________ ( 填序号);
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是___________________ 。
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、 的相互作用分别为
的相互作用分别为_______________ 、_____________ 。
②比较 中的键角∠O−S−O
中的键角∠O−S−O________ H2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是___________ 。
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为_____________________ 。

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=____________ cm3·mol−1 (已知阿伏加德罗常数为NA,晶体的摩尔体积是指单位物质的量晶体所占的体积)。
(1)基态铁原子中,价电子电子云的伸展方向有
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、
 的相互作用分别为
的相互作用分别为②比较
 中的键角∠O−S−O
中的键角∠O−S−O(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=
您最近一年使用:0次
2023-04-14更新
|
503次组卷
|
3卷引用:考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题广东省深圳市龙华中学2022-2023学年高二下学期5月期中考试化学试题
22-23高二下·黑龙江双鸭山·阶段练习
名校
解题方法
5 . 三明清流“天芳悦潭”温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。回答下列问题:
(1)基态Ge原子价电子排布图为_______ 、属于_______ 区。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠: ;二锗酸钠:
;二锗酸钠: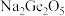 等),也能形成类似于烷烃的锗烷(
等),也能形成类似于烷烃的锗烷( )。
)。
① 中阴离子的空间结构是
中阴离子的空间结构是_______ 。
②推测1mol 中含有的σ键的数目是
中含有的σ键的数目是_______ (用 表示阿伏加德罗常数值)。
表示阿伏加德罗常数值)。
(3)利用离子液体[EMIM][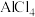 ]可电沉积还原金属Ge,其熔点只有7℃,其中
]可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。
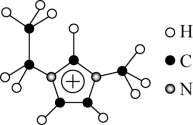
①该物质的晶体类型是_______ 。
② 离子中组成元素的电负性由小到大的顺序是
离子中组成元素的电负性由小到大的顺序是_______ 。
(4)独立的 分子中H−N−H的键角为107.3°,
分子中H−N−H的键角为107.3°, 离子中H−N−H的键角
离子中H−N−H的键角_______ 107.3°(填“大于”、“小于”或“等于”)。
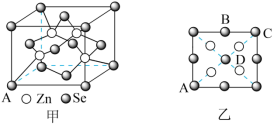
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,该晶胞中两个Zn原子之间的间距是_______ ;乙图为甲图的俯视图,A点坐标为(0,0,0),B点坐标为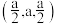 ,则D点坐标为
,则D点坐标为_______ ;若该晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为_______ (只列出计算式)。
(1)基态Ge原子价电子排布图为
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:
 ;二锗酸钠:
;二锗酸钠: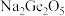 等),也能形成类似于烷烃的锗烷(
等),也能形成类似于烷烃的锗烷( )。
)。①
 中阴离子的空间结构是
中阴离子的空间结构是②推测1mol
 中含有的σ键的数目是
中含有的σ键的数目是 表示阿伏加德罗常数值)。
表示阿伏加德罗常数值)。(3)利用离子液体[EMIM][
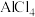 ]可电沉积还原金属Ge,其熔点只有7℃,其中
]可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。
①该物质的晶体类型是
②
 离子中组成元素的电负性由小到大的顺序是
离子中组成元素的电负性由小到大的顺序是(4)独立的
 分子中H−N−H的键角为107.3°,
分子中H−N−H的键角为107.3°, 离子中H−N−H的键角
离子中H−N−H的键角(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,该晶胞中两个Zn原子之间的间距是
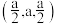 ,则D点坐标为
,则D点坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为
您最近一年使用:0次
22-23高三下·福建泉州·阶段练习
解题方法
6 . 点击化学(click chemistry)是一种能够让分子的构建模块快速、高效地结合在一起的化学反应。科学工作者可以利用基础模块搭建出变化无穷的造型,就如同玩乐高玩具一般。叠氨化物和块经合成抗真菌药物三唑是点击化学的重要应用,反应示例如下:
(1) 的核外电子排布式为
的核外电子排布式为_______ 。
(2)C、N、Cu的电负性由大到小的顺序为_______ 。
(3)分子乙中存在5中心6电子的大 键,其中,提供两个电子形成大
键,其中,提供两个电子形成大 键(
键(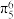 )的原子是
)的原子是_______ (填对应原子的序号)。
(4)分子中碳碳三键的活泼性:甲_______ 丙(填“>”“=”“<”),理由是_______ (从分子的结构角度分析)。
(5)丁形成的晶体中不存在的微粒间作用力有_______ 。
A.离子键 B.极性键 C.非极性键 D.氢键 E.范德华力
(6)CuCl的晶胞中, 的位置如图所示,
的位置如图所示, 填充于
填充于 构成的四面体空隙中。
构成的四面体空隙中。 的配位数为
的配位数为_______ 。
②由 构成的八面体空隙与有
构成的八面体空隙与有 填充的
填充的 构成的四面体空隙的数目之比为
构成的四面体空隙的数目之比为_______ 。
 +CH3CH2N3
+CH3CH2N3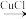

 +CH3CH2N3→
+CH3CH2N3→
(1)
 的核外电子排布式为
的核外电子排布式为(2)C、N、Cu的电负性由大到小的顺序为
(3)分子乙中存在5中心6电子的大
 键,其中,提供两个电子形成大
键,其中,提供两个电子形成大 键(
键(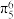 )的原子是
)的原子是(4)分子中碳碳三键的活泼性:甲
(5)丁形成的晶体中不存在的微粒间作用力有
A.离子键 B.极性键 C.非极性键 D.氢键 E.范德华力
(6)CuCl的晶胞中,
 的位置如图所示,
的位置如图所示, 填充于
填充于 构成的四面体空隙中。
构成的四面体空隙中。
 的配位数为
的配位数为②由
 构成的八面体空隙与有
构成的八面体空隙与有 填充的
填充的 构成的四面体空隙的数目之比为
构成的四面体空隙的数目之比为
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
7 . 根据所学知识回答问题
(1)基态Ge原子的核外电子排布式为[Ar]___________ ,有___________ 个未成对电子。光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是___________ 。
(2)镍元素基态原子的电子排布式为___________ ,3d能级上的未成对电子数为___________ 。元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol-1、INi=1 753 kJ·mol-1,ICu>INi的原因是___________ 。
(3)写出基态As原子的核外电子排布式___________ 。根据元素周期律,原子半径Ga___________ As,第一电离能Ga___________ As(填“大于”或“小于”)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)镍元素基态原子的电子排布式为
(3)写出基态As原子的核外电子排布式
您最近一年使用:0次
22-23高三上·广东广州·阶段练习
名校
解题方法
8 . 从废旧锂离子二次电池(主要成分为 ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:

回答下列问题:
(1)“碱浸”的目的是_______ 。
(2)“酸浸”过程中 发生反应的离子方程式为:
发生反应的离子方程式为:_______ 。
(3)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,为使分离率最高,pH一般选择约在_______ 。

(4)若“沉锂”中 ,加入等体积等浓度
,加入等体积等浓度 溶液,此时实验所得沉锂率为
溶液,此时实验所得沉锂率为_______ 。(已知 的
的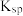 为
为 )
)
(5)化学电池在各行各业都得到了广泛应用,其发展对调整能源结构,实现低碳经济有着重要意义、通过下列反应可以制备某电池正极的活性物质 。
。
请回答下列问题:
①上述反应中涉及的N、O、P元素电负性由小到大的顺序是_______ 。
②基态 原子的价电子排布式为
原子的价电子排布式为_______ 。
③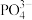 的立体构型为
的立体构型为_______ ,其中P原子的杂化方式是_______ 。
 ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
回答下列问题:
(1)“碱浸”的目的是
(2)“酸浸”过程中
 发生反应的离子方程式为:
发生反应的离子方程式为:(3)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,为使分离率最高,pH一般选择约在

(4)若“沉锂”中
 ,加入等体积等浓度
,加入等体积等浓度 溶液,此时实验所得沉锂率为
溶液,此时实验所得沉锂率为 的
的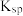 为
为 )
)(5)化学电池在各行各业都得到了广泛应用,其发展对调整能源结构,实现低碳经济有着重要意义、通过下列反应可以制备某电池正极的活性物质
 。
。
请回答下列问题:
①上述反应中涉及的N、O、P元素电负性由小到大的顺序是
②基态
 原子的价电子排布式为
原子的价电子排布式为③
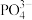 的立体构型为
的立体构型为
您最近一年使用:0次
2022·广东·高考真题
9 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。_______ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: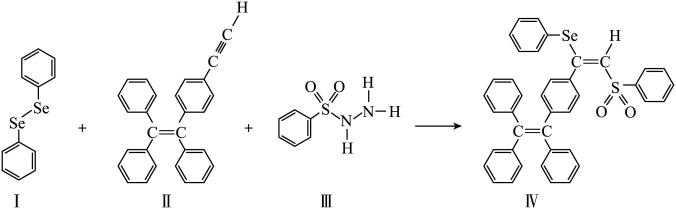
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
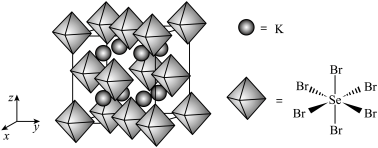
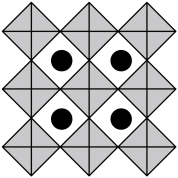
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2022-06-10更新
|
12402次组卷
|
28卷引用:2022年广东卷高考真题变式题(17-21)
(已下线)2022年广东卷高考真题变式题(17-21)(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)题型11 物质结构与性质的综合分析与推断(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)T35-物质结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)2022年新高考广东化学高考真题(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山东省菏泽市单县二中2021-2022学年高二下学期期末测试化学试题山西省晋城市第一中学2022-2023学年高三上学期第五次调研考试化学试题广东省广州中学2022-2023学年高二下学期期中考试化学试题江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷广东省汕头市金禧中学2023-024学年高三上学期第一次阶段考试化学试题上海市实验学校2023-2024学年高三上学期第一次月考化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学广东省广州市第六十五中学2023-2024学年高二下学期期中考试化学试题
2022·北京房山·二模
解题方法
10 . 金属铬及其化合物广泛应用于工业生产中。
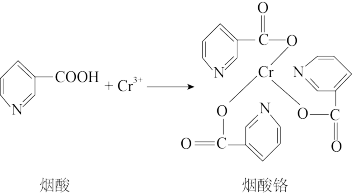
(1)烟酸铬是铬的一种化合物,可促进生物体内的蛋白质合成,提高生物体的免疫力,其合成过程如图:
①H、C、N、O的电负性由大到小的顺序是____ 。
②烟酸中碳原子的杂化方式为____ 。
(2)基态铬原子的核外电子排布式为____ ,有____ 个未成对电子。
(3)铬元素的一种配合物[Cr(H2O)4Cl2]Cl•2H2O,配离子中提供孤电子对的原子为____ ,配位数为____ 。
(4)Cr2O3晶体的熔点为2435℃,而CrCl3晶体易升华,其主要原因是____ 。
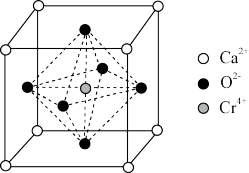
(5)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。该晶体的化学式为____ 。
(1)烟酸铬是铬的一种化合物,可促进生物体内的蛋白质合成,提高生物体的免疫力,其合成过程如图:

①H、C、N、O的电负性由大到小的顺序是
②烟酸中碳原子的杂化方式为
(2)基态铬原子的核外电子排布式为
(3)铬元素的一种配合物[Cr(H2O)4Cl2]Cl•2H2O,配离子中提供孤电子对的原子为
(4)Cr2O3晶体的熔点为2435℃,而CrCl3晶体易升华,其主要原因是
(5)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。该晶体的化学式为

您最近一年使用:0次



