2024·陕西西安·二模
1 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
2023·山东·高考真题
真题
解题方法
2 . 三氯甲硅烷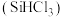 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为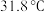 ,熔点为
,熔点为 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
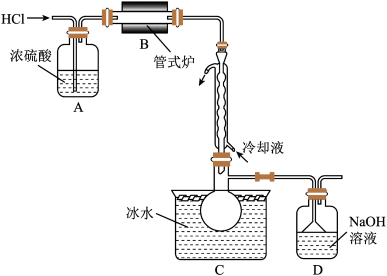
(1)制备 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为_____ ;判断制备反应结束的实验现象是_____ 。图示装置存在的两处缺陷是_____ 。
(2)已知电负性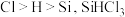 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为_____ 。
(3)采用如下方法测定溶有少量 的
的 纯度。
纯度。
 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①_____ ,②_____ (填操作名称),③称量等操作,测得所得固体氧化物质量为 ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为_____ (填标号)。测得样品纯度为_____ (用含 、
、 的代数式表示)。
的代数式表示)。

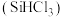 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为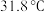 ,熔点为
,熔点为 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
(1)制备
 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为(2)已知电负性
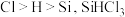 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为(3)采用如下方法测定溶有少量
 的
的 纯度。
纯度。 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-06-19更新
|
10781次组卷
|
16卷引用:2023年高考山东卷化学真题变式题(实验综合题)
(已下线)2023年高考山东卷化学真题变式题(实验综合题)2023年高考山东卷化学真题(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点12 硅及其无机非金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第10讲 硅及其化合物(已下线)T26-工业流程题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点13 硅及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)2024届河北省实验中学高三年级上学期第一次月考化学试题
2023·辽宁·一模
解题方法
3 . 甲磺酸加雷沙星(G)是可用于治疗扁桃体炎的药物,F是合成G的中间体,其合成路线如下:
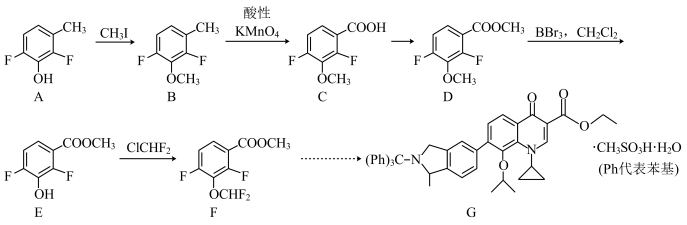
回答下列问题:
(1)B中含氧官能团的名称为___________ ;A中所含元素电负性由大到小的顺序为___________ 。
(2)G中所含碳原子的杂化方式为___________ ;设计反应A→B和D→E的目的为___________ 。
(3)C→D的化学方程式为___________ 。
(4)一分子甲磺酸加雷沙星中含有的手性碳原子数目为___________ 。
(5)苯环上连有5个取代基的B的同分异构体有___________ 种。其中核磁共振氢谱有3组峰的结构简式为___________ 。

回答下列问题:
(1)B中含氧官能团的名称为
(2)G中所含碳原子的杂化方式为
(3)C→D的化学方程式为
(4)一分子甲磺酸加雷沙星中含有的手性碳原子数目为
(5)苯环上连有5个取代基的B的同分异构体有
您最近一年使用:0次
22-23高二下·广东·阶段练习
4 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。请回答下列问题:
(1)基态Br原子核外电子占据最高能级的轨道形状为_______ 。
(2) 的酸性
的酸性_______ (填“大于”或“小于”) 的酸性。HF、HCl、HBr的熔点由大到小的顺序为
的酸性。HF、HCl、HBr的熔点由大到小的顺序为____________ ,原因是______________ 。
(3)卤化物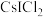 受热发生非氧化还原反应,生成一种无色晶体和一种红棕色液体。写出该反应的化学方程式:
受热发生非氧化还原反应,生成一种无色晶体和一种红棕色液体。写出该反应的化学方程式:__________________ ,解释无色晶体的熔点比红棕色液体高的原因:___________________ 。
(4)AgCl晶胞与NaCl晶胞的结构类似,其立方晶胞结构如图所示。

① 周围最近且等距的
周围最近且等距的 数目为
数目为_______ 。
②设 为阿伏加德罗常数的值,晶体密度为
为阿伏加德罗常数的值,晶体密度为 ,则晶胞边长为
,则晶胞边长为_______ nm。
(1)基态Br原子核外电子占据最高能级的轨道形状为
(2)
 的酸性
的酸性 的酸性。HF、HCl、HBr的熔点由大到小的顺序为
的酸性。HF、HCl、HBr的熔点由大到小的顺序为(3)卤化物
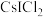 受热发生非氧化还原反应,生成一种无色晶体和一种红棕色液体。写出该反应的化学方程式:
受热发生非氧化还原反应,生成一种无色晶体和一种红棕色液体。写出该反应的化学方程式:(4)AgCl晶胞与NaCl晶胞的结构类似,其立方晶胞结构如图所示。

①
 周围最近且等距的
周围最近且等距的 数目为
数目为②设
 为阿伏加德罗常数的值,晶体密度为
为阿伏加德罗常数的值,晶体密度为 ,则晶胞边长为
,则晶胞边长为
您最近一年使用:0次
22-23高三下·湖南长沙·阶段练习
名校
解题方法
5 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有_______ (填标号)。
A. B.
B.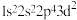 C.
C.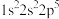
(2)O、F、Cl电负性由大到小的顺序为_______ ; 分子的空间结构为
分子的空间结构为_______ ; 的熔、沸点低于
的熔、沸点低于 ,原因是
,原因是_______ 。
(3)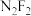 (二氟氮烯)分子中,氮原子的杂化类型为
(二氟氮烯)分子中,氮原子的杂化类型为 ,则
,则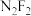 的结构式为
的结构式为_______ 。
(4) 晶体与NaCl晶体结构相似。
晶体与NaCl晶体结构相似。
①设阿伏加德罗常数的值为 ,距离最近的两个
,距离最近的两个 间距为apm,NiO的摩尔质量为
间距为apm,NiO的摩尔质量为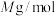 ,则NiO晶体的密度为
,则NiO晶体的密度为_______  。
。
②晶体普遍存在各种缺陷。某种NiO晶体中存在如图所示的缺陷:当一个 空缺,会有两个
空缺,会有两个 被两个
被两个 所取代,但晶体仍呈电中性。经测定某氧化镍样品中
所取代,但晶体仍呈电中性。经测定某氧化镍样品中 与
与 的离子数之比为6∶91.若该晶体的化学式为
的离子数之比为6∶91.若该晶体的化学式为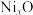 ,则
,则
_______ 。

(1)氟原子激发态的电子排布式有
A.
 B.
B.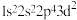 C.
C.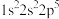
(2)O、F、Cl电负性由大到小的顺序为
 分子的空间结构为
分子的空间结构为 的熔、沸点低于
的熔、沸点低于 ,原因是
,原因是(3)
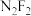 (二氟氮烯)分子中,氮原子的杂化类型为
(二氟氮烯)分子中,氮原子的杂化类型为 ,则
,则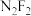 的结构式为
的结构式为(4)
 晶体与NaCl晶体结构相似。
晶体与NaCl晶体结构相似。①设阿伏加德罗常数的值为
 ,距离最近的两个
,距离最近的两个 间距为apm,NiO的摩尔质量为
间距为apm,NiO的摩尔质量为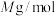 ,则NiO晶体的密度为
,则NiO晶体的密度为 。
。②晶体普遍存在各种缺陷。某种NiO晶体中存在如图所示的缺陷:当一个
 空缺,会有两个
空缺,会有两个 被两个
被两个 所取代,但晶体仍呈电中性。经测定某氧化镍样品中
所取代,但晶体仍呈电中性。经测定某氧化镍样品中 与
与 的离子数之比为6∶91.若该晶体的化学式为
的离子数之比为6∶91.若该晶体的化学式为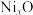 ,则
,则

您最近一年使用:0次
22-23高三上·贵州贵阳·期末
解题方法
6 . 铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)基态Cu原子价电子排布式为_______ 。
(2)K与Cu同周期,最外层电子数相同,但Cu的熔点远高于K,因为_______ 。
(3)含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
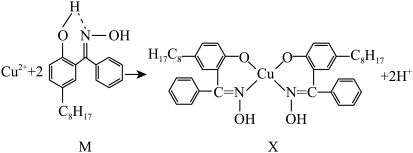
①M所含元素的电负性由大到小顺序是_______ (用元素符号表示)。
②X化合物中中心原子铜的配位数是_______ ,上述反应中断裂和生成的化学键有_______ (填字母序号)。
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
(4)高温下, 比CuO稳定的原因是
比CuO稳定的原因是_______ 。
(5)离子型配合物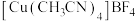 中,阴离子的空间构型为
中,阴离子的空间构型为_______ ,配体中碳原子的杂化方式是_______ 。
(6)由Cu,Sb,Se组成的热电材料,其晶胞结构如图所示, ,
,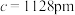 ,该晶体的密度是
,该晶体的密度是_______  (列式即可)
(列式即可)
(1)基态Cu原子价电子排布式为
(2)K与Cu同周期,最外层电子数相同,但Cu的熔点远高于K,因为
(3)含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。

①M所含元素的电负性由大到小顺序是
②X化合物中中心原子铜的配位数是
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
(4)高温下,
 比CuO稳定的原因是
比CuO稳定的原因是(5)离子型配合物
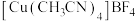 中,阴离子的空间构型为
中,阴离子的空间构型为(6)由Cu,Sb,Se组成的热电材料,其晶胞结构如图所示,
 ,
,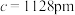 ,该晶体的密度是
,该晶体的密度是 (列式即可)
(列式即可)
您最近一年使用:0次
22-23高三上·山东临沂·期末
名校
7 . 铁、铜及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有_______ 种;试从结构角度解释 易被氧化为
易被氧化为 的原因
的原因_______ ; 是检验
是检验 的特征试剂,
的特征试剂,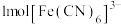 中含有
中含有_______ molσ键。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中VSEPR模型为四面体的非金属原子共有
。该化合物分子中VSEPR模型为四面体的非金属原子共有_______ 个;en中各元素的电负性由小到大的顺序为_______ 。
(3)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。
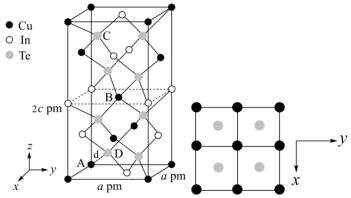
该晶体的化学式为_______ ;A点、B点原子的分数坐标分别为(0,0,0)、( ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为_______ ;晶胞中A、D原子间距离d=_______ cm。
(1)基态Fe原子核外电子的空间运动状态有
 易被氧化为
易被氧化为 的原因
的原因 是检验
是检验 的特征试剂,
的特征试剂,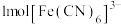 中含有
中含有(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中VSEPR模型为四面体的非金属原子共有
。该化合物分子中VSEPR模型为四面体的非金属原子共有(3)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。

该晶体的化学式为
 ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为
您最近一年使用:0次
2022·山东济南·一模
名校
解题方法
8 . 卤族元素及其化合物种类繁多,有着非常重要的用途,回答下列问题:
(1)基态Br原子的电子排布式为[Ar]____ 。
(2)HF分子的极性____ (填“大于”“等于”或“小于”,以下同)HCl,同一条件下,HF在水中的溶解度____ HCl,HF的沸点____ HCl。SOCl2中心S原子VSEPR模型为____ 。1mol氟硼酸铵NH4BF4中含有____ mol配位键。
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为( ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为____ ,距离Hg最近的Ag有____ 个。设NA为阿伏加德罗常数的值,Ag2HgI4的摩尔质量为Mg•mol-1,该晶体的密度为____ g•cm-3(用代数式表示)。

(1)基态Br原子的电子排布式为[Ar]
(2)HF分子的极性
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为(
 ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为
您最近一年使用:0次
2022-03-22更新
|
1241次组卷
|
3卷引用:山东省济南市2022届高三3月高考模拟考试(一模)(结构与性质)
21-22高二下·湖北·阶段练习
9 . 近年来,科学家研究的以复合过渡金属镍的氢氧化物为催化剂、三乙醇胺为电子给体以及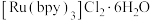 为光敏剂的催化体系,在可见光驱动下可高效催化还原
为光敏剂的催化体系,在可见光驱动下可高效催化还原 。
。
(1)下列有关Ni原子的叙述正确的是___________(填标号)。
(2)三乙醇胺的制备:3 +NH3
+NH3 N(CH2CH2OH)3
N(CH2CH2OH)3
①三乙醇胺中所含的元素(除H元素外),第一电离能由小到大的顺序为___________ 。
②下列关于 和
和 的叙述正确的是
的叙述正确的是___________ 。
A.中心原子的价层电子对数相同
B.中心原子的杂化方式不同
C.分子的VSEPR模型相同
D. 分子的键角比
分子的键角比 分子的键角大
分子的键角大
(3)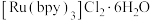 中配体bpy分子的结构简式为
中配体bpy分子的结构简式为 ,分子中N原子的杂化类型为
,分子中N原子的杂化类型为___________ ,则1mol配体bpy分子中含有σ键的数目为___________ 。与bpy分子有相似结构的单环分子吡啶的结构简式为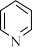 ,吡啶分子中的大
,吡啶分子中的大 键可表示为
键可表示为___________ (用 的形式表示,m表示原子数,n表示电子数)。
的形式表示,m表示原子数,n表示电子数)。
(4)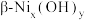 的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为
的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为___________ g/cm3(列出表达式)。
 为光敏剂的催化体系,在可见光驱动下可高效催化还原
为光敏剂的催化体系,在可见光驱动下可高效催化还原 。
。(1)下列有关Ni原子的叙述正确的是___________(填标号)。
| A.第一电离能比钙的大 |
B.基态Ni原子的核外价电子排布式为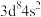 |
C.基态Ni原子形成基态 时,先失去3d轨道上的电子 时,先失去3d轨道上的电子 |
| D.基态Co原子第五电离能比基态Ni原子第五电离能大 |
 +NH3
+NH3 N(CH2CH2OH)3
N(CH2CH2OH)3①三乙醇胺中所含的元素(除H元素外),第一电离能由小到大的顺序为
②下列关于
 和
和 的叙述正确的是
的叙述正确的是A.中心原子的价层电子对数相同
B.中心原子的杂化方式不同
C.分子的VSEPR模型相同
D.
 分子的键角比
分子的键角比 分子的键角大
分子的键角大(3)
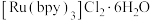 中配体bpy分子的结构简式为
中配体bpy分子的结构简式为 ,分子中N原子的杂化类型为
,分子中N原子的杂化类型为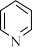 ,吡啶分子中的大
,吡啶分子中的大 键可表示为
键可表示为 的形式表示,m表示原子数,n表示电子数)。
的形式表示,m表示原子数,n表示电子数)。(4)
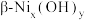 的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为
的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为
您最近一年使用:0次
2022-03-14更新
|
463次组卷
|
3卷引用:2022年山东省高考真题变式题(非选择题)
2021·山东·高考真题
真题
解题方法
10 . 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态F原子核外电子的运动状态有__ 种。
(2)O、F、Cl电负性由大到小的顺序为__ ;OF2分子的空间构型为__ ;OF2的熔、沸点__ (填“高于”或“低于”)Cl2O,原因是___ 。
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为___ ,下列对XeF2中心原子杂化方式推断合理的是___ (填标号)。
A.sp B.sp2 C.sp3 D.sp3d
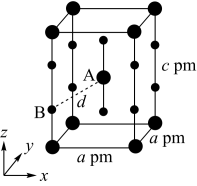
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有__ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为___ ;晶胞中A、B间距离d=___ pm。
(1)基态F原子核外电子的运动状态有
(2)O、F、Cl电负性由大到小的顺序为
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
A.sp B.sp2 C.sp3 D.sp3d
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2021-06-29更新
|
11177次组卷
|
13卷引用:专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】
(已下线)专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】2021年新高考山东化学高考真题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)2021年山东高考化学试题变式题11-20(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)第四部分 物质结构与性质 综合提能训练(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)



