名校
解题方法
1 . 下列说法不正确的是
| A.石墨片层中存在大π键,所以沿片层方向容易导电 |
| B.苯甲酸容易形成分子间氢键,形成二聚分子,所以熔沸点较高 |
| C.碳链可以连接很长,但硅链不可以连接很长,因为Si-Si键的键能小于C-C键的键能 |
| D.依据元素周期律,与相同浓度的稀硫酸反应,Pb比Sn反应剧烈 |
您最近一年使用:0次
2024-01-13更新
|
266次组卷
|
3卷引用:山东省中学联盟2023-2024学年高三上学期12月全省大联考化学试题
山东省中学联盟2023-2024学年高三上学期12月全省大联考化学试题(已下线)化学(九省联考考后提升卷,甘肃卷)-2024年1月“九省联考”真题完全解读与考后提升河南省信阳高级中学2023-2024学年高二下学期开学化学试题
名校
解题方法
2 . 某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的短周期元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。

下列说法正确的是

下列说法正确的是
| A.氧化物对应水化物的酸性:Z<M |
| B.MQ3分子的VSEPR模型为三角锥形 |
| C.Z、M、Q三种元素均能与氢元素形成含非极性键的二元化合物 |
| D.电负性:Q>M>Z>X>Y |
您最近一年使用:0次
2024-01-02更新
|
877次组卷
|
5卷引用:山东省名校联考2024届高三上学期模拟预测化学试题
山东省名校联考2024届高三上学期模拟预测化学试题山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题(已下线)选择题6-10(已下线)选择题6-10(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
解题方法
3 . 某笼形络合物 晶胞结构中,镍离子与
晶胞结构中,镍离子与 连接形成平面层,两个平面层通过
连接形成平面层,两个平面层通过 分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:
分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:

(1)C、N、H电负性大小顺序___________ ;晶胞中N原子的杂化方式为___________ 。
(2)晶胞中镍离子的价电子轨道表示式为___________ ,与镍同周期的元素中,基态原子的未成对电子数与镍相同的有___________ 种。
(3)已知苯环中 键长为npm,则晶胞中A号C原子的分数坐标
键长为npm,则晶胞中A号C原子的分数坐标___________ ;晶胞M中含有 键数目为
键数目为___________ 个。
(4)镍离子的配位数为___________ ,晶胞的密度为___________  (用代数式表示)。
(用代数式表示)。
 晶胞结构中,镍离子与
晶胞结构中,镍离子与 连接形成平面层,两个平面层通过
连接形成平面层,两个平面层通过 分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:
分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:
(1)C、N、H电负性大小顺序
(2)晶胞中镍离子的价电子轨道表示式为
(3)已知苯环中
 键长为npm,则晶胞中A号C原子的分数坐标
键长为npm,则晶胞中A号C原子的分数坐标 键数目为
键数目为(4)镍离子的配位数为
 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
解题方法
4 . 铁、镍、铜、钇( )在医药、催化及材料等领域中应用广泛。回答下列问题:
)在医药、催化及材料等领域中应用广泛。回答下列问题:
(1) 在元素周期表中的位置为
在元素周期表中的位置为________ ,第二周期中基态原子末成对电子数与 相同且电负性最小的元素是
相同且电负性最小的元素是___________ (填元素符号)。
(2)一种某铁的配合物结构如图所示。该物质中不含有的化学键类型是________ (填标号)。

A.离子键 B.配位键 C.非极性共价键 D. 键 E.
键 E. 键
键
在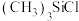 、
、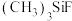 、
、 分子中,
分子中,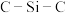 键角最大的是
键角最大的是________ 。
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
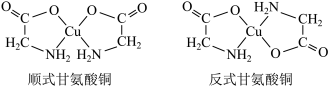
甘氨酸铜中铜原子的杂化类型为___________ (填“ ”或“
”或“ ”);
”);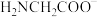 能与
能与 形成稳定的环状化合物,其原因是
形成稳定的环状化合物,其原因是___________ ;顺式甘氨酸铜在水中溶解度远大于反式甘氨酸铜,主要原因是___________ 。
(4)铁酸钇的正交相晶胞结构以及各原子的投影如图所示。
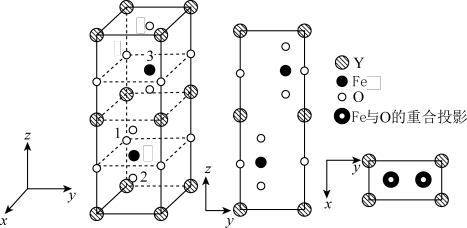
已知1号 原子分数坐标为
原子分数坐标为 ,2号
,2号 原子分数坐标为
原子分数坐标为 ,则3号
,则3号 原子的分数坐标为
原子的分数坐标为___________ ;若晶胞参数为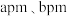 和
和 ,
, ,用
,用 表示阿伏伽德罗常数的值,则该晶体的密度为
表示阿伏伽德罗常数的值,则该晶体的密度为___________  (列出表达式)
(列出表达式)
 )在医药、催化及材料等领域中应用广泛。回答下列问题:
)在医药、催化及材料等领域中应用广泛。回答下列问题:(1)
 在元素周期表中的位置为
在元素周期表中的位置为 相同且电负性最小的元素是
相同且电负性最小的元素是(2)一种某铁的配合物结构如图所示。该物质中不含有的化学键类型是

A.离子键 B.配位键 C.非极性共价键 D.
 键 E.
键 E. 键
键在
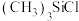 、
、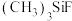 、
、 分子中,
分子中,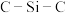 键角最大的是
键角最大的是(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

甘氨酸铜中铜原子的杂化类型为
 ”或“
”或“ ”);
”);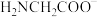 能与
能与 形成稳定的环状化合物,其原因是
形成稳定的环状化合物,其原因是(4)铁酸钇的正交相晶胞结构以及各原子的投影如图所示。

已知1号
 原子分数坐标为
原子分数坐标为 ,2号
,2号 原子分数坐标为
原子分数坐标为 ,则3号
,则3号 原子的分数坐标为
原子的分数坐标为 和
和 ,
, ,用
,用 表示阿伏伽德罗常数的值,则该晶体的密度为
表示阿伏伽德罗常数的值,则该晶体的密度为 (列出表达式)
(列出表达式)
您最近一年使用:0次
解题方法
5 . X、Y、Z为短周期主族元素,化合物 是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体
是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体 。下列说法正确的是
。下列说法正确的是
 是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体
是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体 。下列说法正确的是
。下列说法正确的是A.电负性: 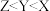 |
| B.基态Z原子和Y原子的未成对电子数相等 |
C. 的空间构型为三角锥形 的空间构型为三角锥形 |
D. 的分子中, 的分子中, 键与 键与 键个数比为2:1 键个数比为2:1 |
您最近一年使用:0次
2023-05-27更新
|
322次组卷
|
2卷引用:山东省潍坊市2023届高三下学期三模化学试题
解题方法
6 .  是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1) 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为___________ 。
(2) 可形成
可形成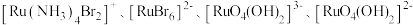 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是___________ ,具有对称结构的 中
中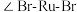 为
为___________ 。图1中通过螯合作用形成配位键的N原子的杂化方式为___________ , 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是___________ 。

(3) 的晶体结构如图2所示。
的晶体结构如图2所示。
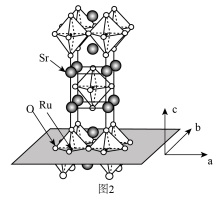
① 和
和 的电负性:
的电负性:
___________  (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为___________ 形。
②用 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
 是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:(1)
 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为(2)
 可形成
可形成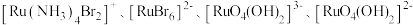 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是 中
中 为
为 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是
(3)
 的晶体结构如图2所示。
的晶体结构如图2所示。
①
 和
和 的电负性:
的电负性:
 (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为②用
 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
7 . 氯化铜是共价化合物,通常用作有机和无机反应催化剂、媒染剂等。 溶液与乙二胺(
溶液与乙二胺( )可形成配离子
)可形成配离子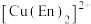 (En是乙二胺的简写),如图所示,下列说法中错误的是
(En是乙二胺的简写),如图所示,下列说法中错误的是
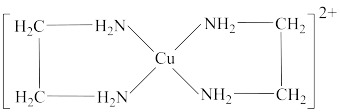
 溶液与乙二胺(
溶液与乙二胺( )可形成配离子
)可形成配离子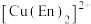 (En是乙二胺的简写),如图所示,下列说法中错误的是
(En是乙二胺的简写),如图所示,下列说法中错误的是
A.基态 的未成对电子数为1 的未成对电子数为1 |
B.配离子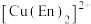 中N原子提供孤对电子 中N原子提供孤对电子 |
C.乙二胺和三甲胺 均属于胺,沸点更高的是三甲胺 均属于胺,沸点更高的是三甲胺 |
D.配离子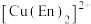 中涉及的元素的电负性由大到小的顺序为N>C>H>Cu 中涉及的元素的电负性由大到小的顺序为N>C>H>Cu |
您最近一年使用:0次
2023-05-21更新
|
434次组卷
|
3卷引用:山东省泰安市2023届高三下学期三模化学试题
名校
8 . 石灰氮( ,其中
,其中 原子间成键方式相同)是一种氮肥,可与土壤中的
原子间成键方式相同)是一种氮肥,可与土壤中的 反应生成氰胺(
反应生成氰胺( ),氰胺可进一步转化为尿素[CO(NH2)2]。下列说法正确的是
),氰胺可进一步转化为尿素[CO(NH2)2]。下列说法正确的是
 ,其中
,其中 原子间成键方式相同)是一种氮肥,可与土壤中的
原子间成键方式相同)是一种氮肥,可与土壤中的 反应生成氰胺(
反应生成氰胺( ),氰胺可进一步转化为尿素[CO(NH2)2]。下列说法正确的是
),氰胺可进一步转化为尿素[CO(NH2)2]。下列说法正确的是A. 的电子式为 的电子式为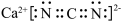 |
B. 的空间构型与 的空间构型与 的空间构型相同且两者键角相等 的空间构型相同且两者键角相等 |
C.氰胺分子中氮原子的杂化方式为 和 和 两种 两种 |
D. 分子中各元素的电负性大小关系为 分子中各元素的电负性大小关系为 |
您最近一年使用:0次
名校
9 . 短周期主族元素W、X、Y、Q的原子序数依次增大。W、X原子的最外层电子数之和为6,且符合核反应: ;Y原子中s电子与p电子数目相同,Q的原子序数等于X原子序数的2倍。下列说法正确的是
;Y原子中s电子与p电子数目相同,Q的原子序数等于X原子序数的2倍。下列说法正确的是
 ;Y原子中s电子与p电子数目相同,Q的原子序数等于X原子序数的2倍。下列说法正确的是
;Y原子中s电子与p电子数目相同,Q的原子序数等于X原子序数的2倍。下列说法正确的是A.电负性: | B.X的最高价氧化物对应的水化物属于强酸 |
C.原子半径: | D.单质Q与X的最高价氧化物可以发生反应 |
您最近一年使用:0次
2023-05-12更新
|
677次组卷
|
4卷引用:山东省聊城市2023届高考一模化学试题
解题方法
10 . 金属锂溶于液氨可得到具有高反应活性的金属电子溶液,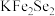 与其作用可制得超导体
与其作用可制得超导体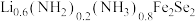 ,进一步可制得超导材料
,进一步可制得超导材料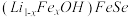 。
。
回答下列问题:
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有______ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是______ (填标号)
A. B.
B. C.
C.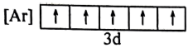 D.
D.
(2)液氨可以发生微弱的电离生成 和
和 ,下列说法错误的是
,下列说法错误的是________
(3)Fe2+可与邻二氮菲形成红色配合物,结构如图所示。元素的电负性从大到小的顺序为______ (填元素符号)。配合物中N原子的VSEPR模型为____________ ;下列对Fe杂化方式推断合理的是______ (填标号)。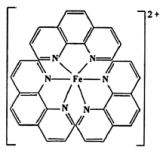
A. B.
B. C.
C. D.
D.
(4)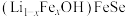 晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是
晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是______ ,铁硒层和锂铁氢氧层之间由极其微弱的氢键相连,该氢键可表示为______ 。已知锂铁氢氧层中锂铁个数之比为4∶1,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为______ g·cm 。
。

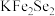 与其作用可制得超导体
与其作用可制得超导体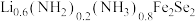 ,进一步可制得超导材料
,进一步可制得超导材料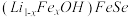 。
。回答下列问题:
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
A.
 B.
B. C.
C. D.
D.
(2)液氨可以发生微弱的电离生成
 和
和 ,下列说法错误的是
,下列说法错误的是A.键角: | B.结合质子能力: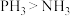 |
C.热稳定性: | D. 与 与 的分子构型及N的化合价均相同 的分子构型及N的化合价均相同 |

A.
 B.
B. C.
C. D.
D.
(4)
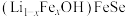 晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是
晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次



