名校
1 . 美国《Scinece》杂志曾报道科学家合成和分离出含高能正离子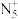 的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种
的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种 ,若
,若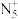 离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
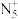 的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种
的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种 ,若
,若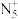 离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是A.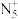 中N原子间形成离子键 中N原子间形成离子键 | B.N5AsF6中As的化合价为+1 |
C. 的摩尔质量为112 的摩尔质量为112 | D. 所含质子数为21 所含质子数为21 |
您最近一年使用:0次
名校
2 . 前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体。已知H2O2的结构式为H-O-O-H下列说法不正确的是
| A.H2NCONH2与H2O2是通过氢键结合的 |
| B.H2O2分子中只含共价键,不含离子键 |
| C.H2NCONH2·H2O2属于离子化合物 |
| D.H2O2既有氧化性又有还原性 |
您最近一年使用:0次
2019-09-07更新
|
330次组卷
|
5卷引用:湖南省长沙市第一中学2020届高三第一次月考化学试题
湖南省长沙市第一中学2020届高三第一次月考化学试题“皖赣联考”2021届高三上学期第三次考试化学试题(已下线)【南昌新东方】10.2020年11月江西南昌师大附中高三上学期期中化学重庆市第七中学2021届高三上学期12月考化学试题湖南省长沙市长郡中学2023-2024学年高一下学期选科适应性检测化学试卷
名校
3 . 下列物质中σ键和π键数目比为1:2的是( )
A.O2  | B.N2  | C.CO2  | D.HCN |
您最近一年使用:0次
2019-06-25更新
|
272次组卷
|
7卷引用:2015-2016学年四川省雅安中学高二上期中考试化学试卷
2015-2016学年四川省雅安中学高二上期中考试化学试卷(已下线)山西省原平市范亭中学2018-2019学年高二4月月考化学试题湖南省长沙市雅礼中字2022-2023学年高二下学期第一次月考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键 课时1 共价键(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)四川省广安市第二中学2021-2022学年高二下学期第一次月考化学试题2.1.1 共价键-随堂练习
名校
4 . 下列各项叙述中正确的是 ( )
| A.电子层序数越大,s原子轨道的形状相同,半径越大 |
| B.在同一电子层上运动的电子,其自旋方向肯定不同 |
| C.镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态 |
| D.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
您最近一年使用:0次
2019-06-14更新
|
1019次组卷
|
16卷引用:2016-2017学年河南省商丘市第一高级中学高二上学期期末考试化学试卷
2016-2017学年河南省商丘市第一高级中学高二上学期期末考试化学试卷河南省兰考县第二高级中学2017-2018学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题湖南省衡阳市田家炳实验中学2021-2022学年高二下学期3月质量检测化学试题(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题新疆昌吉教育共同体2020-2021学年高二下学期期中考试化学试题吉林省延边朝鲜族自治州延边二中北校区2020-2021学年高二下学期第一次月考化学试题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)四川省西昌市2020-2021学年高二下学期期中检测化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题新疆乌鲁木齐高级中学2021-2022学年高二上学期期末考试化学试题山东省乳山市银滩高级中学2022-2023学年高一下学期3月月考化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高二下学期7月期末化学试题
名校
解题方法
5 . Ⅰ.将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L•min)。
xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L•min)。
(1)B的反应速率v(B)=_____________ ,X=_____ 。
(2)此时容器内的压强与开始时之比为_________ 。
Ⅱ.(3)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式____________ ;
b.指出它分子内的化学键的类型_________ 。
(4)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________ 。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________ (填字母)。
A 原子半径:In>Se B In的金属性比Se强
C In的金属性比Al弱 D 硒化铟的化学式为InSe2
 xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L•min)。
xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L•min)。(1)B的反应速率v(B)=
(2)此时容器内的压强与开始时之比为
Ⅱ.(3)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式
b.指出它分子内的化学键的类型
(4)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是
A 原子半径:In>Se B In的金属性比Se强
C In的金属性比Al弱 D 硒化铟的化学式为InSe2
您最近一年使用:0次
12-13高一下·山东济宁·阶段练习
名校
6 . 航天飞船可用肼(N2H4)作动力源。已知1 g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05 kJ热量,化学方程式为N2H4+2H2O2=N2↑+4H2O。下列说法中错误的是 ( )
| A.肼(N2H4)分子中只存在极性共价键 |
| B.此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ |
| C.该反应中肼作还原剂 |
| D.该反应的反应物总能量高于生成物的总能量 |
您最近一年使用:0次
2019-06-10更新
|
996次组卷
|
11卷引用:湖南省双峰县第一中学2017-2018学年高二上期第一次月考化学试题
湖南省双峰县第一中学2017-2018学年高二上期第一次月考化学试题【全国市级联考】湖南省五市十校2018年上学期高一期中考试化学试题(已下线)2012-2013学年山东省济宁市任城一中高一3月质量检测化学试卷2014-2015四川省大竹县文星中学高一4月月考化学试卷辽宁省庄河市高级中学2016-2017学年高一下学期期中考试化学试题河南省周口市扶沟县高级中学2018-2019学年高一下学期第一次月考化学试题【全国百强校】宁夏回族自治区银川一中2018-2019学年高一下学期期中考试化学试题高一必修第二册(人教2019版)第六章 第一节 化学反应与能量变化 课时1 化学反应与能量变化(已下线)6.1.1 化学反应与热能(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)甘肃省静宁县第一中学2020-2021学年高一下学期第一次月考化学(实)试题河南省信阳市2021-2022学年高一下学期期中教学质量检测化学试题
名校
7 . 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
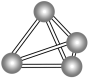

| A.N4分子中只含有非极性键 | B.N4分子属于一种新型的化合物 |
| C.1 mol N4分子所含共价键数为4NA | D.N4沸点比P4(白磷)高 |
您最近一年使用:0次
2019-06-09更新
|
143次组卷
|
16卷引用:2015-2016学年湖南衡阳一中高一下期中化学试卷
2015-2016学年湖南衡阳一中高一下期中化学试卷2015-2016学年江西省崇义中学高一下学期第一次月考化学试卷2015-2016学年湖北省枣阳市白水高中高一5月月考化学试卷2015-2016学年湖北省松滋一中高一下学期期末化学试卷内蒙古杭锦后旗奋斗中学2016-2017学年高一下学期期中考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题河北省永清县第一中学2018-2019学年高一下学期第二次月考化学试题云南省玉溪市江川二中2018-2019学年高一下学期5月份考试化学试题2019—2020学年人教版必修1第一章第三节《化学键》第2课时 《化学键与分子间作用力》(跟踪训练)(已下线)山西省原平市范亭中学2018-2019学年高二4月月考化学试题(已下线)【全国百强校】吉林省延边第二中学2018-2019学年高二下学期期中考试化学试题(已下线)练习15 化学键-2020-2021学年【补习教材·寒假作业】高一化学(人教版)吉林省辽源市田家炳高级中学2020-2021学年高二下学期期中化学试题四川省眉山市仁寿第二中学等四校2020-2021学年高一下学期期中考试(5月)化学试题江西省抚州市南城一中2020-2021学年高一下学期5月月考化学试题云南省马关县一中2020-2021学年高一下学期6月月考化学试题
名校
解题方法
8 . 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______ 。
(2)金属Ni能与CO形成配合物Ni(CO)4,与CO互为等电子体的一种分子为______ (写化学式,下同),与CO互为等电子体的一种离子为______ 。
(3)丁二酮肟( )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______ ,2mol丁二酮肟分子中所含σ键的数目为______ 。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:

①A的熔、沸点高于B的原因为______ 。
②B晶体含有化学键的类型为______ (填选项字母)。
A.σ键 B.金属键 C.配位键 D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______ 。
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______ 。
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为
(2)金属Ni能与CO形成配合物Ni(CO)4,与CO互为等电子体的一种分子为
(3)丁二酮肟(
 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:

①A的熔、沸点高于B的原因为
②B晶体含有化学键的类型为
A.σ键 B.金属键 C.配位键 D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为

您最近一年使用:0次
2019-05-29更新
|
463次组卷
|
7卷引用:【市级联考】湖南省衡阳市2019届高三下学期第三次联考(三模)理科综合化学试题
解题方法
9 . (1)碳能与氢、氮、氧三种元素组成化合物CO(NH2)2,该物质易溶于水的主要原因是____ 。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是________ 。
②MgCO3分解温度比CaCO3低的原因是___________ 。
(3)图①为嘌呤的结构,嘌呤中轨道之间的夹角∠1比∠2大,请解释原因:____________ 。
(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有 键的数目为
键的数目为________ 。
(5)图③为碳的另一种同素异形体一一金刚石的晶胞结构,其中原子坐标参数A为(0,0,0),B为(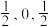 ),C为(
),C为(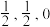 );则D原子的坐标参数为
);则D原子的坐标参数为________ 。____ ,Mn和Se的摩尔质量分别为M1 g/mol、M2 g/mol,该晶体的密度为 g/cm3,则Mn-Se键的键长为
g/cm3,则Mn-Se键的键长为_____ nm(写表达式即可)。 g/cm3,K和I的摩尔质量分别为Mk g・mol-1和MI g・mol-1,原子半径分别为rk pm和rI pm,阿伏加 德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为
g/cm3,K和I的摩尔质量分别为Mk g・mol-1和MI g・mol-1,原子半径分别为rk pm和rI pm,阿伏加 德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______ (写表达式即可)。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是
②MgCO3分解温度比CaCO3低的原因是
(3)图①为嘌呤的结构,嘌呤中轨道之间的夹角∠1比∠2大,请解释原因:
(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有
 键的数目为
键的数目为(5)图③为碳的另一种同素异形体一一金刚石的晶胞结构,其中原子坐标参数A为(0,0,0),B为(
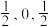 ),C为(
),C为(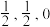 );则D原子的坐标参数为
);则D原子的坐标参数为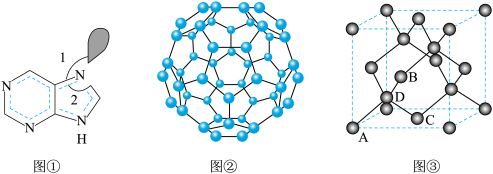
 g/cm3,则Mn-Se键的键长为
g/cm3,则Mn-Se键的键长为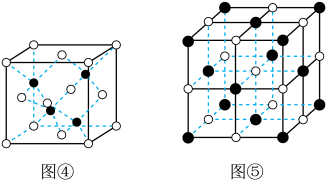
 g/cm3,K和I的摩尔质量分别为Mk g・mol-1和MI g・mol-1,原子半径分别为rk pm和rI pm,阿伏加 德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为
g/cm3,K和I的摩尔质量分别为Mk g・mol-1和MI g・mol-1,原子半径分别为rk pm和rI pm,阿伏加 德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为
您最近一年使用:0次
名校
解题方法
10 . 根据物质结构相关知识,回答下列问题:
(1)在第三周期的元素中,第一电离能介于Mg与Cl之间的有__________ 种。
(2)碳元素与氮元素形成的某种晶体的晶胞如图所示,其中8个C原子位于立方体的顶点,4个C原子位于立方体的面心,4个N原子在立方体内。
①已知该晶体硬度超过金刚石,其原因是_________________ 。
②晶胞中C原子的杂化方式为___________ 。
③知该晶胞参数为a nm,阿伏伽德罗常数用NA表示,则该晶体的密度为________ g·cm-3
(3)大π键可表示为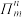 ,其中m代表参与形成的大π键原子数,n表示大π键的电子数,如
,其中m代表参与形成的大π键原子数,n表示大π键的电子数,如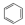 的大π键可表示为
的大π键可表示为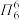 ,则CO32-中的大π键可表示为
,则CO32-中的大π键可表示为_________________ 。
(4)金属铬是一种极硬、耐腐蚀的银白色金属,其化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+等。
①基态铬原子的价电子排布式为________________ 。
②配离子[Cr(H2O)3(NH3)3]3+的结构可能有_________ 种。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AIP的熔点为2000℃,其晶胞结构如下图所示。
①C点的原子坐标为_______________ 。
②AlP的晶胞中,Al原子位于P原子形成的正四面体空隙中,此空隙的填充率为_____ 。
(1)在第三周期的元素中,第一电离能介于Mg与Cl之间的有
(2)碳元素与氮元素形成的某种晶体的晶胞如图所示,其中8个C原子位于立方体的顶点,4个C原子位于立方体的面心,4个N原子在立方体内。
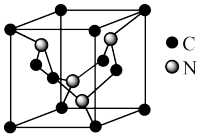
①已知该晶体硬度超过金刚石,其原因是
②晶胞中C原子的杂化方式为
③知该晶胞参数为a nm,阿伏伽德罗常数用NA表示,则该晶体的密度为
(3)大π键可表示为
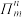 ,其中m代表参与形成的大π键原子数,n表示大π键的电子数,如
,其中m代表参与形成的大π键原子数,n表示大π键的电子数,如 的大π键可表示为
的大π键可表示为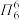 ,则CO32-中的大π键可表示为
,则CO32-中的大π键可表示为(4)金属铬是一种极硬、耐腐蚀的银白色金属,其化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+等。
①基态铬原子的价电子排布式为
②配离子[Cr(H2O)3(NH3)3]3+的结构可能有
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AIP的熔点为2000℃,其晶胞结构如下图所示。
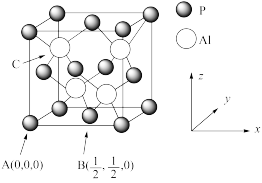
①C点的原子坐标为
②AlP的晶胞中,Al原子位于P原子形成的正四面体空隙中,此空隙的填充率为
您最近一年使用:0次



