1 . 美国宇航局马里诺娃博士找到了一种比二氧化碳有效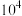 倍的“超级温室气体”—全氟丙烷(
倍的“超级温室气体”—全氟丙烷( ),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
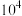 倍的“超级温室气体”—全氟丙烷(
倍的“超级温室气体”—全氟丙烷( ),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是| A.分子中三个碳原子可能在同一直线上 | B.相同压强下,沸点: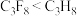 |
C.电子式为: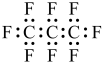 | D.分子中既有极性键又有非极性键 |
您最近半年使用:0次
名校
解题方法
2 . 下列有关性质的比较,正确的是
①硬度: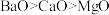
②水溶性:CH3CH2OH>CH3CH2OCH2CH3
③沸点: HCl>HF
④晶格能:
⑤分子或离子中键角: ,
,
⑥熔点: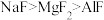 3
3
⑦沸点:H2O>HF>NH3
⑧熔点:金刚石>生铁>纯铁>钠
⑨熔点:二氧化硅>NaCl>I2>冰
①硬度:
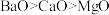
②水溶性:CH3CH2OH>CH3CH2OCH2CH3
③沸点: HCl>HF
④晶格能:

⑤分子或离子中键角:
 ,
,
⑥熔点:
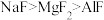 3
3⑦沸点:H2O>HF>NH3
⑧熔点:金刚石>生铁>纯铁>钠
⑨熔点:二氧化硅>NaCl>I2>冰
| A.①②⑦⑨ | B.①②⑤⑦⑨ | C.②④⑥⑦ | D.②⑤⑦⑨ |
您最近半年使用:0次
名校
解题方法
3 . 下列说法中,正确的是
| A.冰融化时,分子中H—O发生断裂 |
| B.共价晶体中,共价键越强,熔点越高 |
| C.分子晶体中,共价键键能越大,该分子晶体的熔沸点一定越高 |
| D.分子晶体中,分子间作用力越大,对应的物质越稳定 |
您最近半年使用:0次
2022-05-09更新
|
257次组卷
|
23卷引用:2015-2016学年贵州省思南中学高二下第二次月考化学试卷
2015-2016学年贵州省思南中学高二下第二次月考化学试卷江苏省射阳县盘湾中学、陈洋中学2017-2018学年高二上学期期末考试化学试题吉林省汪清县第六中学2018-2019学年高二下学期期中考试化学试题吉林省吉林市第三中学2018-2019学年高二5月阶段测试化学试题云南省江城一中2018-2019学年高二下学期期末考试化学试题辽宁省丹东市第四中学2019-2020学年高二 4 月线上月考化学试题辽宁省丹东市第四中学2019-2020学年高二5月线上月考化学试题辽宁省六校协作体2019-2020高二下学期期初考试化学试卷(鲁科版2019)选择性必修2 模块综合测评(人教版2019)选择性必修2 第三章 晶体结构与性质 第二节 分子晶体与共价晶体(已下线)模块同步卷08 分子晶体与原子晶体-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)北京市第十三中学2020-2021学年高二下学期期中考试化学试题人教2019选择性必修2第三章第二节 分子晶体与共价晶体课后习题北京师范大学附属中学2021-2022学年高三上学期期中考试化学试题3.2.2 共价晶体-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)(已下线)一轮巩固卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)河北省衡水市第二中学2021-2022学年高二下学期期中考试化学试题广东省深圳市龙岗区龙城高级中学2021-2022学年高二下学期期中考试化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二下学期期中考试化学试题广东省梅州市五华县五华中学2021-2022学年高二下学期期中考试化学试题 新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期中考试化学试题3.2.2共价晶体与分子晶体(课后)-鲁科版选择性必修2重庆市璧山来凤中学校2023-2024学年高二下学期3月月考化学试题
11-12高二下·山西忻州·阶段练习
名校
解题方法
4 . 下列有关物质性质、结构的表述均正确,且存在因果关系的是
| 选项 | 表述1 | 表述2 |
| A | 在水中, 的溶解度比 的溶解度比 的溶解度大 的溶解度大 |  晶体中 晶体中 与 与 间的作用力大于碘晶体中分子间的作用力 间的作用力大于碘晶体中分子间的作用力 |
| B | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
| C | 通常条件下, 分子比 分子比 分子稳定性强 分子稳定性强 |  的原子半径比C的大, 的原子半径比C的大, 与H之间的键能比C与H之间的键能小 与H之间的键能比C与H之间的键能小 |
| D |  、 、 溶于水后均不导电 溶于水后均不导电 |  、 、 均属于共价化合物 均属于共价化合物 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-05-01更新
|
396次组卷
|
14卷引用:2011-2012学年山西省忻州一中高二下学期第一次月考化学试卷
(已下线)2011-2012学年山西省忻州一中高二下学期第一次月考化学试卷福建省厦门市湖滨中学2018-2019学年高二(理)上学期期中考试化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二下学期期中考试化学试题宁夏回族自治区石嘴山市平罗中学2019-2020学年高二上学期期中考试化学试题福建省厦门市思明区厦门外国语学校2019-2020学年高二上学期周末练习10——化学试题湖北省武汉市黄陂区第六中学2019-2020学年高二下学期三月线上考试化学试题吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题陕西省西安市长安区第一中学2020-2021学年高二上学期第二次月考化学试题辽宁省朝阳市第一高级中学2020-2021学年高二上学期期末考试化学试题(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题广东省广州市(广大附,铁一,广外)三校2021-2022学年高二下学期期中联考化学试题江苏省苏州市2021-2022学年高二上学期期末模块测评化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
5 . 关于物质的结构和性质,下列说法正确的是
A.某 晶体的硬度大于金刚石,构成该 晶体的硬度大于金刚石,构成该 晶体的微粒间作用力是分子间作用力 晶体的微粒间作用力是分子间作用力 |
B.同C与O相似, 与O原子间也能形成稳定的π键 与O原子间也能形成稳定的π键 |
C.吡啶(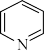 )和吡咯( )和吡咯(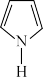 )分子中所有原子均共面,分别含有 )分子中所有原子均共面,分别含有 和 和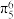 的大π键 的大π键 |
D.二茂铁甲酰胺(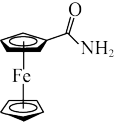 )中,C原子和N原子均为 )中,C原子和N原子均为 杂化 杂化 |
您最近半年使用:0次
名校
6 . 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)B2A4分子中σ键和π键个数比为_______ 。
(2)A、B、C、D四种元素的电负性从大到小的顺序为_______ (用元素符号表示)。
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是_______ 。
(4)元素E能形成多种配合物,如:E(CO)5等。
①基态E原子的价电子排布图为_______ 。
②E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于_______ (填晶体类型),该晶体中E的化合价为_______ 。
(5)E和C形成的一种化合物的晶胞结构如图所示,该晶胞的化学式为_______ 。若两个最近的E原子间的距离为acm,则该晶体的密度是_______ g·mL-1。

(1)B2A4分子中σ键和π键个数比为
(2)A、B、C、D四种元素的电负性从大到小的顺序为
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是
(4)元素E能形成多种配合物,如:E(CO)5等。
①基态E原子的价电子排布图为
②E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于
(5)E和C形成的一种化合物的晶胞结构如图所示,该晶胞的化学式为

您最近半年使用:0次
名校
7 . 从实验测得不同物质中氧氧之间的键长和键能的数据:
其中x、y的键能数据尚未测定,但可根据规律推导键能的大小顺序为w>z>y>x;该规律是
O | O | O2 | O | |
| 键长(10-12m) | 149 | 128 | 121 | 112 |
| 键能(kJ·mol-1) | x | y | z=494 | w=628 |
| A.成键的电子数越多,键能越大 | B.键长越长,键能越小 |
| C.成键所用的电子数越少,键能越小 | D.成键时电子对越偏移,键能越大 |
您最近半年使用:0次
2022-04-02更新
|
804次组卷
|
11卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.1 第2课时
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.1 第2课时第2章 化学键与分子间作用力——易错疑难集训(一)——A学习区 夯实基础(鲁科版选修3)(已下线)2.1.2 键参数——键能、键长和键角-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)第2.1.2讲 键参数——键能、键长与键角-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)云南省宣威市第三中学2021-2022学年高二下学期3月份考试化学试题四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷(已下线)第39练 共价键-2023年高考化学一轮复习小题多维练(全国通用)(已下线)2022年北京高考真题变式题15-19四川省成都市武侯高级中学2021-2022学年高二下学期期中考试化学试题第二章 分子结构与性质(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)(已下线)2022年北京高考真题化学试题变式题(选择题6-10)
名校
8 . 下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是

下列说法正确的是
A.沸点: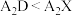 |
B. 分子是非极性分子 分子是非极性分子 |
C.C形成的单质中 键与 键与 键个数之比为1∶2 键个数之比为1∶2 |
| D.B、C、D形成的简单气态氢化物互为等电子体 |
您最近半年使用:0次
2022-03-24更新
|
340次组卷
|
18卷引用:2015-2016学年山东省淄博市高青一中高二4月月考化学试卷
2015-2016学年山东省淄博市高青一中高二4月月考化学试卷2016-2017学年河南省师范大学附属中学高二下学期第二次月考理科综合化学试卷湖北省襄阳市第四中学2017-2018学年高二12月月考化学试题人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题海南省三亚华侨学校2019-2020学年高二上学期期中考试化学试题四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题2020高三总复习二轮复习——物质结构与性质复习卷2020届高三化学二轮物质结构题型专攻——分子结构与性质【选择基础专练】山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题第2章 化学键与分子间作用力——C挑战区模拟高考(鲁科版选修3)(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 章末综合检测卷(已下线)模块同步卷07 第二章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)山西省忻州市岢岚县中学2020-2021学年高二下学期4月月考化学试题山西省大同市灵丘县第一中学等名校2021-2022学年高二下学期3月联考化学试题内蒙古赤峰市2021-2022学年高二下学期期末考试化学试题山东省青岛市胶州市实验中学2022-2023学年高二下学期3月月考化学试题陕西省宝鸡市渭滨区2022-2023学年高二下学期期末检测化学试题
解题方法
9 . 实验室常利用“棕色环”现象检验 离子。其方法为:取含有
离子。其方法为:取含有 的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:
的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:
(1)形成“棕色环”主要发生如下反应:
3[Fe(H2O)6]2++ +4H+=3[Fe(H2O)6]3++NO↑+2H2O
+4H+=3[Fe(H2O)6]3++NO↑+2H2O
[Fe(H2O)6]2++NO=[Fe(NO)(H2O)5]2+(棕色)+H2O
[Fe(NO)(H2O)5]2+中,配位数为___________ 。
(2)与 互为等电子体的微粒是
互为等电子体的微粒是___________ (任写一例)。
(3) 的空间构型是
的空间构型是___________ ,其中N原子的杂化方式是___________ 。
(4)铁原子在不同温度下排列构成不同晶体结构,在912℃以下排列构成的晶体叫做α-铁;在912℃至1394℃之间排列构成的晶体叫做γ-铁;在1394℃以上排列构成的晶体,叫做δ-铁。晶胞剖面结构如图所示:

①γ-铁的原子堆积方式为___________ 。α-Fe、δ-Fe晶胞中铁原子个数比为___________ 。
②已知γ-铁晶体密度为dg/cm3,则Fe原子的半径为___________ nm(用含d、NA的式子表示)。
 离子。其方法为:取含有
离子。其方法为:取含有 的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:
的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:(1)形成“棕色环”主要发生如下反应:
3[Fe(H2O)6]2++
 +4H+=3[Fe(H2O)6]3++NO↑+2H2O
+4H+=3[Fe(H2O)6]3++NO↑+2H2O[Fe(H2O)6]2++NO=[Fe(NO)(H2O)5]2+(棕色)+H2O
[Fe(NO)(H2O)5]2+中,配位数为
(2)与
 互为等电子体的微粒是
互为等电子体的微粒是(3)
 的空间构型是
的空间构型是(4)铁原子在不同温度下排列构成不同晶体结构,在912℃以下排列构成的晶体叫做α-铁;在912℃至1394℃之间排列构成的晶体叫做γ-铁;在1394℃以上排列构成的晶体,叫做δ-铁。晶胞剖面结构如图所示:

①γ-铁的原子堆积方式为
②已知γ-铁晶体密度为dg/cm3,则Fe原子的半径为
您最近半年使用:0次
13-14高二下·福建福州·期末
名校
10 . 下列化合物分子中既含σ键又含π键的是
A. | B. | C.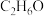 | D. |
您最近半年使用:0次
2022-01-22更新
|
919次组卷
|
15卷引用:2013-2014福建省福州八县高二下学期期末考试化学试卷
(已下线)2013-2014福建省福州八县高二下学期期末考试化学试卷陕西省岐山县2017-2018学年高二下学期期末质量检测(结构)化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键 课时1 共价键(已下线)2.1 共价键(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题广东省东莞市光明中学2021-2022学年高二上学期第一次月考化学试题四川省乐山市十校2021-2022学年高二上学期期中考试化学试题山西省名校联考2021-2022学年高二上学期期末考试化学试题(已下线)第二章 分子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)福建省三明第一中学2021-2022学年高二下学期第二次月考化学试题新疆石河子第一中学2021-2022学年高二4月月考化学试题福建省三明第一中学2021-2022学年高二下学期第一次月考化学试题河南省平顶山市龙河实验高级中学2021-2022学年高二下学期期中考试化学试题新疆昌吉州行知学校2021-2022学年高二下学期第一次月考化学试题广西钦州市第一中学2022-2023学年高二下学期期中考试化学试题



