名校
1 . 下列关于化学键类型和分子构型的说法正确的是
A.I3AsF6晶体中存在的I 空间构型与水分子相同 空间构型与水分子相同 |
| B.H2O分子间存在氢键,故H2O的稳定性均大于H2S |
| C.P4和CH4的分子构型相同,键角相等 |
| D.尿素[CO(NH2)2]分子中σ键和π键数目之比为5:1 |
您最近一年使用:0次
2023-04-29更新
|
353次组卷
|
5卷引用:山东省青岛胶州市2020-2021学年高二下学期期末考试化学试题
山东省青岛胶州市2020-2021学年高二下学期期末考试化学试题江苏省阜宁中学等5校2022-2023学年高二上学期1月期末考试化学试题江苏省盐城市大丰中学、盐城一中等六校2022-2023学年高二上学期期末联考化学试卷(已下线)专题06 物质的结构与性质 元素推断-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)陕西师范大学附属中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
2 . 乙炔是有机合成工业的一种重要原料。工业上曾用焦炭制备电石 (CaC2),再与水反应制备乙炔。
(1)焦炭、金刚石和C60都是碳的单质。已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为140~145pm ,二者比较熔点高的是_______ ,理由是_______ 。
(2)乙炔与氢氰酸反应可得丙烯腈 ,丙烯腈分子中碳原子轨道杂化类型是
,丙烯腈分子中碳原子轨道杂化类型是_______ ,该分子中 键与
键与 键个数比为
键个数比为_______ 。
(3)将乙炔通入 溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为
溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为_______ ; 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:_______ 。
(4)CaC2中C 与O
与O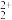 互为等电子体,O
互为等电子体,O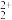 的电子式为
的电子式为_______ 。
(5)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃形C 的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的C
的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的C 有
有_______ 个;已知CaC2晶体密度为 ,晶胞中两个C
,晶胞中两个C 的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=_______ cm。
(6)钾和铜都是第四周期元素,且原子的最外层电子数相同,铜的熔沸点远大于钾的原因是_______ 。
(7)CuSO4·5H2O结构示意图如下,CuSO4·5H2O中存在的相互作用有_______ (填序号,下同),加热该蓝色胆矾晶体得到白色硫酸铜固体破坏的相互作用有_______ 。

A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
(1)焦炭、金刚石和C60都是碳的单质。已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为140~145pm ,二者比较熔点高的是
(2)乙炔与氢氰酸反应可得丙烯腈
 ,丙烯腈分子中碳原子轨道杂化类型是
,丙烯腈分子中碳原子轨道杂化类型是 键与
键与 键个数比为
键个数比为(3)将乙炔通入
 溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为
溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:(4)CaC2中C
 与O
与O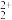 互为等电子体,O
互为等电子体,O 的电子式为
的电子式为(5)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃形C
 的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的C
的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的C 有
有 ,晶胞中两个C
,晶胞中两个C 的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
(6)钾和铜都是第四周期元素,且原子的最外层电子数相同,铜的熔沸点远大于钾的原因是
(7)CuSO4·5H2O结构示意图如下,CuSO4·5H2O中存在的相互作用有

A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
您最近一年使用:0次
3 . 联氨(N2H4)可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述正确的是
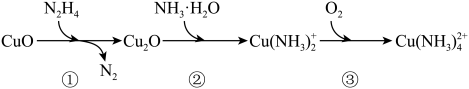

| A.N2H4分子中σ键与π键的数目之比为5:1 | B.1molN2H4可处理水中1molO2 |
| C.[Cu(NH3)4]2+中存在离子键、配位键和极性共价键 | D.NH3与H2O均为非极性分子 |
您最近一年使用:0次
解题方法
4 . 按要求回答下列问题。
(1)下列基态原子或离子的电子排布式或轨道表示式正确的是_______ (填序号,下同),违反能量最低原理的是_______ ,违反泡利不相容原理的是_______ ,违反洪特规则的是_______ 。
①Si:
②Al:
③Co3+最外层:
④Mg2+:1s22s22p6
⑤Sc:1s22s22p63s23p63d3
⑥Cr:1s22s22p63s23p63d54s1
(2)物质:①甲烷 ②硫化氢 ③氢氧化镁 ④氨气 ⑤乙烯
(1)下列基态原子或离子的电子排布式或轨道表示式正确的是
①Si:

②Al:

③Co3+最外层:

④Mg2+:1s22s22p6
⑤Sc:1s22s22p63s23p63d3
⑥Cr:1s22s22p63s23p63d54s1
(2)物质:①甲烷 ②硫化氢 ③氢氧化镁 ④氨气 ⑤乙烯
| 条件 | 符合条件物质的序号 |
| 既含极性键又含非极性键 | |
| 含有极性键的极性分子 | |
| 上述分子中键角由大到小的顺序 |
您最近一年使用:0次
5 . 下列有关物质性质说法中,正确的是
| A.s-sσ键与s-p σ键的电子云形状相同 |
| B.热稳定性:HF>HI>HBr>HCl |
| C.具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是① |
| D.某元素气态基态原子的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+,其最高正价为+5价 |
您最近一年使用:0次
6 . 回答下列问题:
(1)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有_____ 。

A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C-C-C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物III相比,水溶性较好的是_____ 。
(3)NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是____ 。
(4) 中含有各元素的电负性由小到大的顺序为
中含有各元素的电负性由小到大的顺序为____ ;该物质中,含有σ键和π键数目之比为____ 。
(5)在CO分子中每个原子均为8电子稳定结构,则C与O之间形成_____ 个σ键____ 个π键,在这些化学键中,O原子共提供了____ 个电子。
(6)乙腈(CH3CN)分子中碳原子的杂化类型有____ ,与N同周期的主族元素中,第一电离能大于N的有_____ 种,写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式_____ ,NO 离子的立体构型是
离子的立体构型是____ 。
(7)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
锰元素位于第四周期第VIIB族。请写出基态Mn2+的价电子排布式:_____ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_____ 。
(1)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有

A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C-C-C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物III相比,水溶性较好的是
(3)NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是
(4)
 中含有各元素的电负性由小到大的顺序为
中含有各元素的电负性由小到大的顺序为(5)在CO分子中每个原子均为8电子稳定结构,则C与O之间形成
(6)乙腈(CH3CN)分子中碳原子的杂化类型有
 互为等电子体的分子的化学式
互为等电子体的分子的化学式 离子的立体构型是
离子的立体构型是(7)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
您最近一年使用:0次
7 . 联氨(N2H4)可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述正确的是


| A.N2H4分子中σ键与π键的数目之比为5:1 | B.1molN2H4可处理水中1molO2 |
| C.[Cu(NH3)4]2+中存在离子键、配位键和极性共价键 | D.NH3与H2O均为非极性分子 |
您最近一年使用:0次
名校
解题方法
8 . 硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
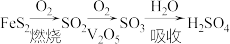
(1)基态 原子核外未成对电子数为
原子核外未成对电子数为_______ , 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 中
中 原子的杂化类型为
原子的杂化类型为_______ , 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为_______ 。
(2)分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大键的原子数,
代表参与形成大键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为_______ 。 分子中键角
分子中键角
_______ 键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
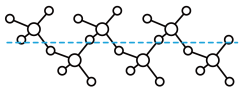
(3) 分子的空间构型为
分子的空间构型为_______ 。固态 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是_______ (填“桥氧”或“端基氧”)。
(4)绿矾是一种重要的硫酸盐,其组成可写成 ,则绿矾中含有的微粒间作用力有_______。
,则绿矾中含有的微粒间作用力有_______。
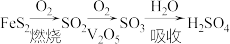
(1)基态
 原子核外未成对电子数为
原子核外未成对电子数为 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 中
中 原子的杂化类型为
原子的杂化类型为 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为(2)分子中的大
 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大键的原子数,
代表参与形成大键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为 分子中键角
分子中键角
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(3)
 分子的空间构型为
分子的空间构型为 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
(4)绿矾是一种重要的硫酸盐,其组成可写成
 ,则绿矾中含有的微粒间作用力有_______。
,则绿矾中含有的微粒间作用力有_______。| A.离子键 | B.共价键 | C.配位键 | D.氢键 |
您最近一年使用:0次
名校
9 . 下列描述中正确的是
A. 是空间构型为 是空间构型为 形的极性分子 形的极性分子 |
B. 、 、 和 和 的中心原子均为 的中心原子均为 杂化 杂化 |
C.将过量的氨水加入到 溶液中,最终得到蓝色沉淀 溶液中,最终得到蓝色沉淀 |
D.双原子或多原子形成的气体单质中,一定有 键,可能有 键,可能有 键 键 |
您最近一年使用:0次
解题方法
10 . 1932年美国化学家鲍林首先提出了电负性(用x表示)的概念。表中是某些短周期元素的x值:
(1)表格元素中,第一电离能最小的元素的基态原子电子排布式为____ 。
(2)通过分析x值变化规律,确定N元素x值范围:____<x(N)<____。____
(3)第一电离能大小:Mg____ Al(填“大于”“小于”)。
(4)S元素和Cl元素基态原子核外未成对电子数之比为____ 。
(5)某有机化合物结构中含S-N键,其共用电子对偏向____ (写原子名称)。
(6)经验规律告诉我们:当成键的两原子相应元素的x差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键。试推断AlBr3中化学键类型是____ 。
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)通过分析x值变化规律,确定N元素x值范围:____<x(N)<____。
(3)第一电离能大小:Mg
(4)S元素和Cl元素基态原子核外未成对电子数之比为
(5)某有机化合物结构中含S-N键,其共用电子对偏向
(6)经验规律告诉我们:当成键的两原子相应元素的x差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键。试推断AlBr3中化学键类型是
您最近一年使用:0次



