1 . 中科院大连化学物理研究所科学家用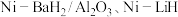 等作催化剂,实现了在常压、
等作催化剂,实现了在常压、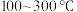 的条件下合成氨,这一成果发表在
的条件下合成氨,这一成果发表在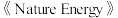 杂志上。
杂志上。
(1)基态Ni2+的价层电子的轨道表示式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸 是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸中C原子的杂化方式为___________ ,晶体类型是___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
(3)NH3分子中的键角为107°,但在 中NH3分子的键角如图所示,导致这种变化的原因是
中NH3分子的键角如图所示,导致这种变化的原因是___________ 。___________ mol-1 (列出表达式)。
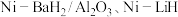 等作催化剂,实现了在常压、
等作催化剂,实现了在常压、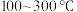 的条件下合成氨,这一成果发表在
的条件下合成氨,这一成果发表在 杂志上。
杂志上。(1)基态Ni2+的价层电子的轨道表示式为
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸
 是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
是组成最简单的氨基酸,熔点为182℃,沸点为233℃。①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸中C原子的杂化方式为
(3)NH3分子中的键角为107°,但在
 中NH3分子的键角如图所示,导致这种变化的原因是
中NH3分子的键角如图所示,导致这种变化的原因是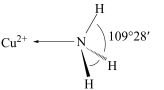
您最近一年使用:0次
名校
2 . 二茂铁 的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究思维新领域。已知二茂铁的熔点是
的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究思维新领域。已知二茂铁的熔点是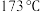 (在
(在 以上能升华),沸点是
以上能升华),沸点是 ,不溶于水,易溶于苯、乙醚等有机溶剂。下列说法正确的是
,不溶于水,易溶于苯、乙醚等有机溶剂。下列说法正确的是
 的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究思维新领域。已知二茂铁的熔点是
的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究思维新领域。已知二茂铁的熔点是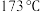 (在
(在 以上能升华),沸点是
以上能升华),沸点是 ,不溶于水,易溶于苯、乙醚等有机溶剂。下列说法正确的是
,不溶于水,易溶于苯、乙醚等有机溶剂。下列说法正确的是A.在二茂铁中, 与 与 之间形成的化学键类型是离子键 之间形成的化学键类型是离子键 |
| B.二茂铁属于离子晶体 |
C. 中 中 键和π键个数之比为 键和π键个数之比为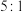 |
D.已知环戊二烯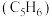 的结构式为 的结构式为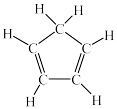 ,则分子环戊二烯中有2个碳原子采用 ,则分子环戊二烯中有2个碳原子采用 杂化 杂化 |
您最近一年使用:0次
3 . 硝基胍是固体火箭推进剂的重要组分,其结构简式如图所示。
(1)硝基胍分子中含有的共价键类型为___________ (从成键方式角度考虑)。
(2)硝基胍分子中C、H、O、N四种元素,这四种元素___________ (填“能”或“不能”)形成离子化合物。
(3)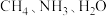 三种分子的中心原子杂化类型相同,但键角大小为
三种分子的中心原子杂化类型相同,但键角大小为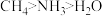 ,原因是
,原因是___________ 。
(4)硝基胍中N原子的杂化方式为___________ 。从结构上分析硝基胍___________ (填“易”或“不”)溶于水,原因是___________ 。
(5)下图中表示的碳原子能量最高的是___________(填字母)。

(1)硝基胍分子中含有的共价键类型为
(2)硝基胍分子中C、H、O、N四种元素,这四种元素
(3)
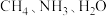 三种分子的中心原子杂化类型相同,但键角大小为
三种分子的中心原子杂化类型相同,但键角大小为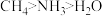 ,原因是
,原因是(4)硝基胍中N原子的杂化方式为
(5)下图中表示的碳原子能量最高的是___________(填字母)。
A.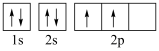 | B.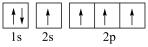 |
C.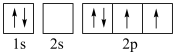 | D.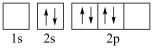 |
您最近一年使用:0次
名校
解题方法
4 . 磷酰氯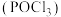 是有机合成的催化剂,其制取原理为
是有机合成的催化剂,其制取原理为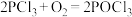 或
或 ,
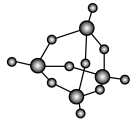
, 分子的空间结构模型如图所示。下列说法错误的是
分子的空间结构模型如图所示。下列说法错误的是
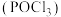 是有机合成的催化剂,其制取原理为
是有机合成的催化剂,其制取原理为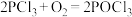 或
或 ,
, 分子的空间结构模型如图所示。下列说法错误的是
分子的空间结构模型如图所示。下列说法错误的是
A. 分子中所有的原子都满足8电子稳定结构 分子中所有的原子都满足8电子稳定结构 |
B.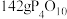 中含有 中含有 键的数目为 键的数目为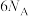 ( ( 为阿伏加德罗常数的值) 为阿伏加德罗常数的值) |
C. 常用作干燥剂,但不可以用来干燥氨气 常用作干燥剂,但不可以用来干燥氨气 |
D. 可与 可与 反应生成 反应生成 |
您最近一年使用:0次
7日内更新
|
163次组卷
|
2卷引用:甘肃省陇南市部分学校2023-2024学年高三下学期化学押题考试(三模)化学试题
解题方法
5 . 按要求回答下列问题:
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是___________ 。
(2)晶体中H2O 和 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为___________ ,试判断 H2O 和  的键角大小关系并说明原因:
的键角大小关系并说明原因:___________ 。
(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为___________ , 雌黄和 SnCl2 在盐酸中反应转化为雄黄(As4S4)和 SnCl4 并放出 H2S 气体。___________ 。
(5)Zn2+的核外电子排布式为___________ ,在元素周期表中,该元素在___________ (填“s”“p”“d”“f”或“ds”)区。。
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,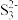 的空间结构为
的空间结构为___________ 。
(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为___________ 。
(8)Na3AsO4 中含有的化学键类型包括___________ ; 的空间结构为
的空间结构为 ___________ 。
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是
(2)晶体中H2O 和
 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为 的键角大小关系并说明原因:
的键角大小关系并说明原因:(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为

(5)Zn2+的核外电子排布式为
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,
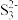 的空间结构为
的空间结构为(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为
(8)Na3AsO4 中含有的化学键类型包括
 的空间结构为
的空间结构为
您最近一年使用:0次
6 . 回答下问题:
(1)Sm的价层电子排布式为 4f66s2 ,Sm3+价层电子排布式为___________ 。
(2)依据第二周期元素第一电离能的变化规律,参照如图元素 B 、F 的位置,用小黑点标 出 C 、N 、O 三种元素的相对位置___________ 。___________ 。
(4)H2S 和 H2Se 的参数对比见下表,其中 H2S 的键角大于 H2Se 的键角的原因可能为___________
(1)Sm的价层电子排布式为 4f66s2 ,Sm3+价层电子排布式为
(2)依据第二周期元素第一电离能的变化规律,参照如图元素 B 、F 的位置,用小黑点标 出 C 、N 、O 三种元素的相对位置

(4)H2S 和 H2Se 的参数对比见下表,其中 H2S 的键角大于 H2Se 的键角的原因可能为
| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
您最近一年使用:0次
名校
解题方法
7 . 氢能是一种重要的清洁能源,由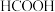 可以制得
可以制得 。在催化剂作用下,
。在催化剂作用下,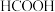 催化释放氢的反应机理和相对能量的变化情况分别如图1和图2所示。下列叙述正确的是
催化释放氢的反应机理和相对能量的变化情况分别如图1和图2所示。下列叙述正确的是
 可以制得
可以制得 。在催化剂作用下,
。在催化剂作用下,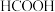 催化释放氢的反应机理和相对能量的变化情况分别如图1和图2所示。下列叙述正确的是
催化释放氢的反应机理和相对能量的变化情况分别如图1和图2所示。下列叙述正确的是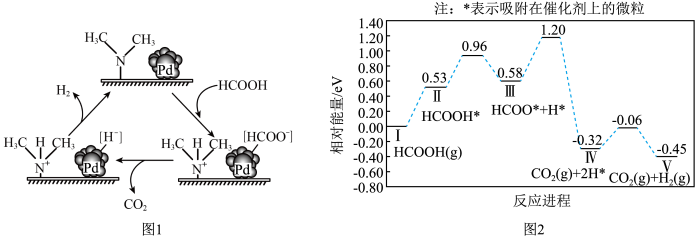
A. 催化释放氢的过程中有非极性键的断裂与形成 催化释放氢的过程中有非极性键的断裂与形成 |
B.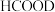 催化释放氢反应除生成 催化释放氢反应除生成 外,还生成 外,还生成 |
C.在催化剂表面解离 键比解离 键比解离 键难 键难 |
D.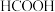 催化释放氢的热化学方程式为: 催化释放氢的热化学方程式为: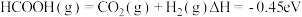 |
您最近一年使用:0次
2024-05-29更新
|
261次组卷
|
3卷引用:甘肃省民乐县第一中学2023-2024学年高三下学期5月第一次模拟考化学试卷
名校
8 . 氨气在一定条件下催化还原含 的尾气,反应为
的尾气,反应为 ,下列说法错误的是
,下列说法错误的是
 的尾气,反应为
的尾气,反应为 ,下列说法错误的是
,下列说法错误的是| A.氮氧化物的排放可形成酸雨 |
| B.氨气分子的键角小于甲烷的键角 |
C.该反应的氧化产物和还原产物的质量比为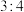 |
D.反应 能说明 能说明 不是酸性氧化物 不是酸性氧化物 |
您最近一年使用:0次
2024-05-27更新
|
46次组卷
|
2卷引用:2024届甘肃省民乐县第一中学高三下学期5月模拟考试化学试卷
名校
9 . 叙述1和叙述2均正确且二者相关性不匹配的是
| 选项 | 叙述1 | 叙述2 |
| A | 电离常数 : : | 电负性: |
| B | 热稳定性: | 分子间作用力: |
| C | 熔点:金刚石>锗(Ge)晶体 | 原子半径: |
| D |  溶解度: 溶解度: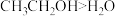 | 分子极性: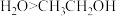 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-19更新
|
99次组卷
|
2卷引用:甘肃省张掖市某校2023-2024学年高三下学期模拟考试化学试题
名校
10 . 短周期主族元素X、Y、Z、T在元素周期表中相对位置如图所示。

| A.在元素周期表中Ⅹ的电负性最大 | B.第一电离能大小为: |
C.简单氢化物的键角大小为: | D.T的最高价含氧酸一定是强酸 |
您最近一年使用:0次
2024-05-19更新
|
65次组卷
|
2卷引用:甘肃省张掖市某校2023-2024学年高三下学期模拟考试化学试题



