名校
解题方法
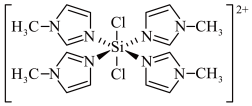
1 . 已知SiCl4与N﹣甲基咪唑(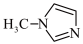 )反应可以得到M2+,其结构如图所示;下列说法不正确的是
)反应可以得到M2+,其结构如图所示;下列说法不正确的是
 )反应可以得到M2+,其结构如图所示;下列说法不正确的是
)反应可以得到M2+,其结构如图所示;下列说法不正确的是
| A.M2+离子中Si的配位数是6 |
| B.1个M2+中含有42个σ键 |
| C.SiF4、SiCl4、SiBr4、SiI4的沸点依次升高 |
| D.气态SiCl4分子的空间构型为正四面体 |
您最近一年使用:0次
名校
解题方法
2 . 世界上首个五氮阴离子盐是(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。回答下列问题:

(1)基态氮原子的价电子的轨道表达式为_______ 。
(2)从结构角度分析,R中两种阳离子的相同之处为_______。(填标号)
(3)R中阴离子N 中的σ键总数为
中的σ键总数为_______ 个。分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则N
),则N 中的大π键应表示为
中的大π键应表示为_______ 。
(4)图中虚线代表氢键,其表示式为(H3O+)O—H…N、_______ 、_______ 。

(1)基态氮原子的价电子的轨道表达式为
(2)从结构角度分析,R中两种阳离子的相同之处为_______。(填标号)
| A.中心原子的杂化轨道类型 | B.中心原子的价层电子对数 |
| C.VSEPR模型名称 | D.共价键类型 |
 中的σ键总数为
中的σ键总数为 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则N
),则N 中的大π键应表示为
中的大π键应表示为(4)图中虚线代表氢键,其表示式为(H3O+)O—H…N、
您最近一年使用:0次
名校
解题方法
3 . 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
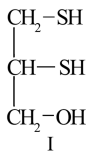

(1)H2S、CH4、H2O的沸点由高到低顺序为_______ 。
(2)汞的原子序数为80,位于元素周期表第_______ 周期第_______ 族。
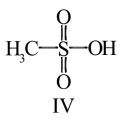
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV_______ 硫酸(填“>”或“<”)
(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有_______ 。
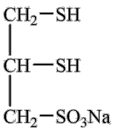
Ⅲ
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是_______ 。(填“化合物I”或“化合物Ⅲ”)


(1)H2S、CH4、H2O的沸点由高到低顺序为
(2)汞的原子序数为80,位于元素周期表第
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV

(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有

Ⅲ
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是
您最近一年使用:0次
名校
解题方法
4 . A、B、C、D均为18电子分子。A为双原子分子且为浅黄绿色气体; B的水溶液常用于医用消毒;C有臭鸡蛋气味;D为烃(烃只含C、H元素)。下列判断错误的是
| A.D分子中心原子发生sp3杂化 |
| B.C分子中的化学键为sp3—s σ键,有轴对称性,可以旋转 |
| C.B为极性分子,但分子中同时含有极性键和非极性键 |
| D.A的键能在同主族单质中最大 |
您最近一年使用:0次
名校
5 . 下列说法错误的有几项
①电负性的大小可以作为判断元素非金属性强弱的依据
②第四周期元素中,未成对电子数最多的元素位于钾元素后面第五位
③键长等于成键两原子的半径之和
④只要分子的空间结构为平面三角形,中心原子均为sp2杂化
⑤价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
⑥H2O比H2S稳定是因为水分子间存在氢键
⑦卤素单质、卤素氢化物、卤素碳化物(CX4)的熔、沸点均随着相对分子质量的增大而升高
⑧邻羟基苯甲醛分子间不存在氢键
⑨晶胞是晶体中最小的平行六面体
⑩测定某一固体是否是晶体可用X射线衍射仪进行实验
①电负性的大小可以作为判断元素非金属性强弱的依据
②第四周期元素中,未成对电子数最多的元素位于钾元素后面第五位
③键长等于成键两原子的半径之和
④只要分子的空间结构为平面三角形,中心原子均为sp2杂化
⑤价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
⑥H2O比H2S稳定是因为水分子间存在氢键
⑦卤素单质、卤素氢化物、卤素碳化物(CX4)的熔、沸点均随着相对分子质量的增大而升高
⑧邻羟基苯甲醛分子间不存在氢键
⑨晶胞是晶体中最小的平行六面体
⑩测定某一固体是否是晶体可用X射线衍射仪进行实验
| A.5项 | B.4项 | C.3项 | D.2项 |
您最近一年使用:0次
解题方法
6 . 白磷溶于过量 溶液的反应为:
溶液的反应为: 。
。 可用于化学镀铜,反应为:
可用于化学镀铜,反应为: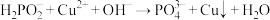 (未配平)。下列说法正确的是
(未配平)。下列说法正确的是
 溶液的反应为:
溶液的反应为: 。
。 可用于化学镀铜,反应为:
可用于化学镀铜,反应为: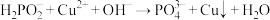 (未配平)。下列说法正确的是
(未配平)。下列说法正确的是A. 的空间结构为正四面体形键角为109°28′ 的空间结构为正四面体形键角为109°28′ |
B. 的结构为 的结构为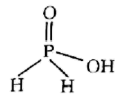 |
C. 中磷原子的杂化方式 中磷原子的杂化方式 杂化 杂化 |
D.理论上 反应可镀铜64g 反应可镀铜64g |
您最近一年使用:0次
7 . 短周期非金属元素X、Y、Z、W的原子序数依次增大,基态X原子的未成对电子数是其所在周期中最多的,基态W原子的电子总数是其最高能级电子数的4倍。四种元素与 元素组成的某化合物的结构如图所示。下列说法错误的是
元素组成的某化合物的结构如图所示。下列说法错误的是
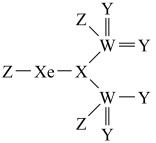
 元素组成的某化合物的结构如图所示。下列说法错误的是
元素组成的某化合物的结构如图所示。下列说法错误的是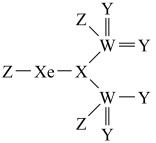
A.第一电离能: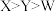 |
B. 和 和 的 的 模型相同 模型相同 |
C.最简单氢化物的沸点: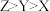 |
| D.X和W的最高价氧化物对应水化物的浓溶液都具有强氧化性 |
您最近一年使用:0次
2021-11-04更新
|
321次组卷
|
2卷引用:湖北省部分重点中学2021-2022学年高三上学期期中第一次联考化学试题
名校
8 . 下列叙述中正确的是
| A.CS2为V形的极性分子,微粒间的作用力为范德华力 |
B.ClO 的空间结构为平面三角形 的空间结构为平面三角形 |
| C.氯化硼(BCl3)的B原子价层电子对数为4,含有一对孤电子对,呈三角锥形 |
D.SiF4和SO 的中心原子均为sp3杂化,SiF4分子呈正四面体形,SO 的中心原子均为sp3杂化,SiF4分子呈正四面体形,SO 呈三角锥形 呈三角锥形 |
您最近一年使用:0次
2021-10-27更新
|
664次组卷
|
6卷引用:2021年湖北高考化学试题变式题1-10
名校
解题方法
9 . 已知A、B、C、D都是短周期元素,它们的原子半径大小顺序为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。
试回答下列问题(用元素符号或化学式表示):
(1)基态B原子中,核外存在___________ 个未成对电子。
(2)基态E2+的核外电子排布式为___________ 。
(3)基态D原子的最高能层的电子排布图为___________
(4)M分子中B原子轨道的杂化类型为___________ 。
(5)B、C、D三种元素的第一电离能由小到大的顺序为___________ 。
试回答下列问题(用元素符号或化学式表示):
(1)基态B原子中,核外存在
(2)基态E2+的核外电子排布式为
(3)基态D原子的最高能层的电子排布图为
(4)M分子中B原子轨道的杂化类型为
(5)B、C、D三种元素的第一电离能由小到大的顺序为
您最近一年使用:0次
2021-10-26更新
|
291次组卷
|
5卷引用:湖北省潜江市华中师范大学潜江附属中学高二上学期12月月考化学试题
名校
解题方法
10 . 二茂铁 的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
 的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是| A.二茂铁属于分子晶体 |
B.在二茂铁中, 与 与 之间形成的化学键类型是离子键 之间形成的化学键类型是离子键 |
C.已知环戊二烯的结构式为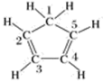 ,则其中仅有1个碳原子采取 ,则其中仅有1个碳原子采取 杂化 杂化 |
D. 中一定含有 中一定含有 键 键 |
您最近一年使用:0次
2021-10-14更新
|
1107次组卷
|
24卷引用:湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题
湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题2017届安徽省安庆市怀宁中学等六校高三第一次联考化学试卷2016-2017学年河南省郑州外国语学校高二下学期月考(一)化学试卷福建省安溪一中、养正中学、惠安一中、泉州实验中学2016-2017学年高二下学期期末联考化学试题第3章 物质的聚集状态与物质性质——C挑战区 模拟高考(鲁科版选修3)福建省厦门双十中学2018-2019学年高二下学期期中考试化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期第四次质量监测化学试题福建省龙岩第一中学2021-2022学年高二(实验班)下学期第一次月考化学试题湖南省长沙市望城区第一中学2022届高三下学期期中考试化学试题(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-14新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题全书综合测评-苏教版选择性必修2第三章 本章达标检测2山西省太原市英才学校2021-2022学年高二下学期线上期中化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期末考试化学试题河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题山东省昌乐第一中学2022-2023学年高二下学期第一次月考化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题福建省莆田第二十五中学2023-2024学年高二下学期第一次质量检化学试题



