名校
解题方法
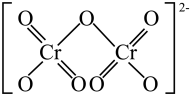
1 .  与足量KOH溶液反应的方程式为:
与足量KOH溶液反应的方程式为: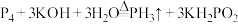 。下列说法不正确的是
。下列说法不正确的是
 与足量KOH溶液反应的方程式为:
与足量KOH溶液反应的方程式为: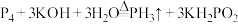 。下列说法不正确的是
。下列说法不正确的是A. 是三元酸 是三元酸 | B. 为非极性分子 为非极性分子 |
C. 的空间结构为V形 的空间结构为V形 | D. 的键角小于 的键角小于 的键角 的键角 |
您最近一年使用:0次
2023-10-13更新
|
215次组卷
|
3卷引用:重庆市2024届高三上学期第二次质量检测化学试题
解题方法
2 . 二氯化二硫(S2Cl2)在工业上常用作橡胶的低温硫化剂。某小组利用单质S与少量Cl2在110-140℃条件下反应合成S2Cl2,查阅有关资料后,得到如下信息:
设计如图所示实验装置(部分夹持装置、加热装置均已略去):
回答下列问题:
(1)仪器E的名称为___________
(2)实验过程中,需要控制装置D的温度,温度不宜过高的原因是___________
判断反应已进行完全的实验现象是___________
(3)S2Cl2与H2O2结构相似,推测S2Cl2为___________ 分子(填“极性”“非极性”),S的杂化类型为___________
(4)有同学认为该装置存在一定的缺陷,指出存在的问题并提出改进方案:___________
(5)取F中黄色液体mg于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的c1mol/L的AgNO3溶液V1mL,再向锥形瓶中加入硝基苯,将生成的沉淀覆盖,加入适量Fe(NO3)3作指示剂,用c2mol/LNaSCN溶液滴定至终点,消耗NaSCN溶液V2mL(滴定过程发生反应:Ag++SCN-=AgSCN↓)
①S2Cl2遇水反应,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原色,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式:___________
②滴定终点的现象为___________
③S2Cl2的纯度为___________ (写出表达式),滴定过程中加入硝基苯将生成的沉淀覆盖,这样操作的目的是___________ 。
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 113 | 445 | ___________ |
| S2Cl2 | -80 | 138 | ①常温下,为黄红色液体,能与水反应 ②300℃以上完全分解 ③在加热条件下会被Cl2氧化成+2价硫 |

回答下列问题:
(1)仪器E的名称为
(2)实验过程中,需要控制装置D的温度,温度不宜过高的原因是
判断反应已进行完全的实验现象是
(3)S2Cl2与H2O2结构相似,推测S2Cl2为
(4)有同学认为该装置存在一定的缺陷,指出存在的问题并提出改进方案:
(5)取F中黄色液体mg于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的c1mol/L的AgNO3溶液V1mL,再向锥形瓶中加入硝基苯,将生成的沉淀覆盖,加入适量Fe(NO3)3作指示剂,用c2mol/LNaSCN溶液滴定至终点,消耗NaSCN溶液V2mL(滴定过程发生反应:Ag++SCN-=AgSCN↓)
①S2Cl2遇水反应,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原色,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式:
②滴定终点的现象为
③S2Cl2的纯度为
您最近一年使用:0次
名校
解题方法
3 . 锰酸锂(LiMn2O4) 可作为某锂离子电池的正极材料,工业上利用软锰矿浆(主要成分为 MnO2,含少量 Fe2O3、FeO、Al2O3、SiO2。等杂质)吸收含硫烟气(主要成分 SO2) 制备锰酸锂,生产流程如图所示:

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
(1)含硫烟气中 SO2的VSEPR模型为___________ 。
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是___________ 。
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:___________ 。
(4)滤液1中所含金属阳离子除 以外还有
以外还有___________ (填离子符号)。
(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入___________ ,再加入NaOH溶液调节pH范围为___________ ,过滤得到滤液 2 和滤渣,请设计实验方案由滤渣制得纯净 Al(OH)3[Al(OH)3在 pH≥12时溶解]的实验方案:___________ 。
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:___________ 。
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:
 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为___________ 。

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)含硫烟气中 SO2的VSEPR模型为
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:
(4)滤液1中所含金属阳离子除
 以外还有
以外还有(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:

 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为
您最近一年使用:0次
名校
4 . 工业上以CO2和NH3为原料合成尿素,下图是反应历程及相对能量变化,历程中的所有物质均为气态。下列说法正确的是
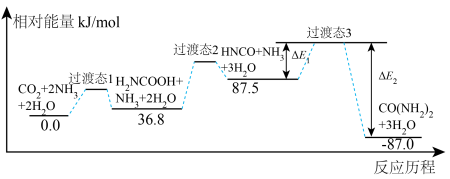

| A.反应中氨气被氧化 |
| B.若ΔE1=66kJ/mol,则△E2=240.5kJ/mol |
| C.该反应的速率控制步骤对应的反应热是△H=+36.8kJ/mol |
| D.历程中,N 原子杂化方式不变 |
您最近一年使用:0次
名校
解题方法
5 . 2-丁烯加成反应:CH3CH=CHCH3+H2O CH3CHOHCH2CH3,下列说法错误的是
CH3CHOHCH2CH3,下列说法错误的是
 CH3CHOHCH2CH3,下列说法错误的是
CH3CHOHCH2CH3,下列说法错误的是| A.CH3CHOHCH2CH3的名称是:2-丁醇 |
B.H2O的VSEPR模型: |
C.基态氧原子核外电子轨道表示式: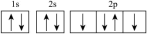 |
D.反-2-丁烯的球棍模型为: |
您最近一年使用:0次
2023-09-23更新
|
112次组卷
|
2卷引用:重庆市第一中学校2023-2024学年高三上学期开学考试化学试题
名校
解题方法
6 . 氢、碳、氮、氧元素的单质及化合物在很多领域有着广泛的应用。回答下列问题:
(1)画出基态N原子的轨道表示式___________ 。
(2)下列分子中,① ,②
,② ,③
,③ ,④
,④ ,⑤
,⑤ ,⑥
,⑥ ,⑦
,⑦ 既有
既有 键又有
键又有 键的是
键的是___________ (填序号,下同);以极性键结合,具有直线形结构的非极性分子是___________ ; 分子中N原子的杂化轨道类型是
分子中N原子的杂化轨道类型是___________ 。
(3)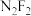 (二氟氮烯)分子中的氮原子采用
(二氟氮烯)分子中的氮原子采用 杂化,则
杂化,则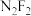 的结构式为
的结构式为_________ 。
(4)重铬酸铵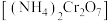 常用作有机合成催化剂,
常用作有机合成催化剂, 的结构如图。
的结构如图。 中
中 键数目为
键数目为___________  。
。
(5)利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成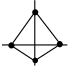 )替代,图a、b分别为T-碳的晶胞和俯视图,图c为金刚石晶胞。
)替代,图a、b分别为T-碳的晶胞和俯视图,图c为金刚石晶胞。
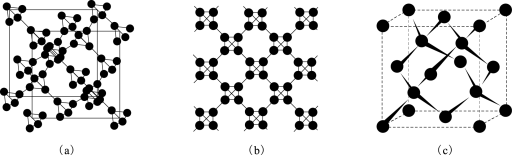
一个T-碳晶胞中含有___________ 个碳原子,T-碳的密度为金刚石的一半,则T-碳晶胞和金刚石晶胞的棱长之比为___________ 。
(1)画出基态N原子的轨道表示式
(2)下列分子中,①
 ,②
,② ,③
,③ ,④
,④ ,⑤
,⑤ ,⑥
,⑥ ,⑦
,⑦ 既有
既有 键又有
键又有 键的是
键的是 分子中N原子的杂化轨道类型是
分子中N原子的杂化轨道类型是(3)
 (二氟氮烯)分子中的氮原子采用
(二氟氮烯)分子中的氮原子采用 杂化,则
杂化,则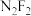 的结构式为
的结构式为(4)重铬酸铵
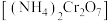 常用作有机合成催化剂,
常用作有机合成催化剂, 的结构如图。
的结构如图。 中
中 键数目为
键数目为 。
。
(5)利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成
 )替代,图a、b分别为T-碳的晶胞和俯视图,图c为金刚石晶胞。
)替代,图a、b分别为T-碳的晶胞和俯视图,图c为金刚石晶胞。
一个T-碳晶胞中含有
您最近一年使用:0次
名校
解题方法
7 . 下列说法正确的是
A.乙二胺(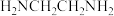 )的沸点低于 )的沸点低于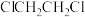 |
B.金刚石晶体中,碳原子数目与碳碳键数目之比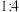 |
C. 的空间结构为V形,中心原子的杂化方式为 的空间结构为V形,中心原子的杂化方式为 |
D.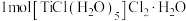 和足量 和足量 溶液反应,能产 溶液反应,能产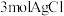 |
您最近一年使用:0次
名校
8 . 下列关于SO2、SO3、NH3、NH 说法中正确的是
说法中正确的是
 说法中正确的是
说法中正确的是| A.SO2水溶液能导电,SO2是电解质 | B.NH 中含有配位键 中含有配位键 |
| C.SO3中硫原子轨道杂化类型为sp3 | D.NH3为非极性分子 |
您最近一年使用:0次
名校
解题方法
9 . 钴配合物[Co(NH3)6]Cl3溶于热水,在冷水中微溶,难溶于乙醇,可通过如下反应制备:2CoCl2+2NH4Cl+10NH3+H2O2 [Co(NH3)6]Cl3+2H2O。该反应放出大量的热,制备具体步骤如下:
[Co(NH3)6]Cl3+2H2O。该反应放出大量的热,制备具体步骤如下:
I.称取2.0g NH4Cl于三颈烧瓶中,用5mL水溶解。
II.分批加入3.0g CoCl2·6H2O后,将溶液温度降至10℃以下,加入1g活性炭、7mL浓氨水,搅拌下逐滴加入10mL 6%的双氧水。
III.加热至55~60℃反应20min。冰水浴冷却,过滤。
IV.将滤得的固体转入含有少量盐酸的25mL沸水中,趁热过滤。
V.滤液转入烧杯,加入4mL浓盐酸,冷却、过滤、用乙醇洗涤晶体并干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤I中使用的玻璃仪器有三颈烧瓶、___________ 、___________ 。
(2)步骤II中,逐滴加入10mL 6%的双氧水若改为一次性加入会出现的问题是___________ 。
(3)步骤III中,冰水浴冷却的目的是___________ ,步骤IV趁热过滤掉的主要物质为___________ 。
(4)步骤V中加入浓盐酸的目的是___________ ,用乙醇洗涤与蒸馏水洗涤相比优点是___________ 。
(5)上述实验过程中若不使用活性炭作催化剂,则会得到紫红色晶体Co(NH3)5Cl3(M=250.5g·mol-1)。取2.505g紫红色晶体,溶于水后加入足量AgNO3溶液,生成白色沉淀2.870g,写出该反应的化学方程式___________ 。
 [Co(NH3)6]Cl3+2H2O。该反应放出大量的热,制备具体步骤如下:
[Co(NH3)6]Cl3+2H2O。该反应放出大量的热,制备具体步骤如下:I.称取2.0g NH4Cl于三颈烧瓶中,用5mL水溶解。
II.分批加入3.0g CoCl2·6H2O后,将溶液温度降至10℃以下,加入1g活性炭、7mL浓氨水,搅拌下逐滴加入10mL 6%的双氧水。
III.加热至55~60℃反应20min。冰水浴冷却,过滤。
IV.将滤得的固体转入含有少量盐酸的25mL沸水中,趁热过滤。
V.滤液转入烧杯,加入4mL浓盐酸,冷却、过滤、用乙醇洗涤晶体并干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤I中使用的玻璃仪器有三颈烧瓶、
(2)步骤II中,逐滴加入10mL 6%的双氧水若改为一次性加入会出现的问题是
(3)步骤III中,冰水浴冷却的目的是
(4)步骤V中加入浓盐酸的目的是
(5)上述实验过程中若不使用活性炭作催化剂,则会得到紫红色晶体Co(NH3)5Cl3(M=250.5g·mol-1)。取2.505g紫红色晶体,溶于水后加入足量AgNO3溶液,生成白色沉淀2.870g,写出该反应的化学方程式
您最近一年使用:0次
2023-09-16更新
|
130次组卷
|
3卷引用:重庆市乌江新高考协作体2023-2024学年高二下学期4月月考化学试题
名校
解题方法
10 . 下列离子方程式错误的是
A. 溶液滴入 溶液滴入 溶液中: 溶液中: |
B.向硫化钠溶液通入足量二氧化硫: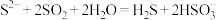 |
C. 与稀硫酸混合: 与稀硫酸混合: |
D.酸性 溶液遇 溶液遇 变成绿色: 变成绿色: |
您最近一年使用:0次



