名校
解题方法
1 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)元素F简单离子的价电子排布式为___________ ;写出元素G在周期表中的位置___________ 。
(2)B与氢元素形成的简单气态氢化物的空间构型为___________ ,C与氢元素形成的简单气态氢化物的VSEPR模型为___________ 。
(3)C、D、E三种元素的简单离子半径由大到小的顺序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为___________ 。
(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ 化合物(填“离子”或“共价”);M的最高价氧化物对应的水化物与NaOH溶液反应的化学方程式为___________ 。
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: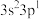 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)B与氢元素形成的简单气态氢化物的空间构型为
(3)C、D、E三种元素的简单离子半径由大到小的顺序为
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 顺铂的结构简式为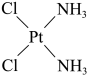 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为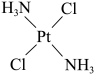 ,无抗癌作用;碳铂的结构简式为
,无抗癌作用;碳铂的结构简式为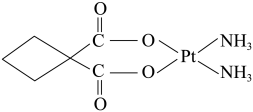 。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成
。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成 。请回答下列问题:
。请回答下列问题:
(1)下列说法正确的是_______(填序号)。
(2)根据碳铂的结构简式推断,1mol1,1—环丁二羧酸中含有 键的数目为
键的数目为_______ 。
(3)顺铂和反铂的物理性质有很大差异,其中只有_______ 易溶于水,原因是_______ 。
(4)乙烯酮分子中碳原子的杂化类型为_______ ;乙烯酮在一定条件下可聚合成双乙烯酮(结构简式为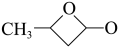 ),双乙烯酮分子中含有的
),双乙烯酮分子中含有的 键和
键和 键的数目之比为
键的数目之比为_______ 。
(5)由于氢键的存在,乙酸分子间也可形成二聚体(含八元环),该二聚体的结构为_______ 。
 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为 ,无抗癌作用;碳铂的结构简式为
,无抗癌作用;碳铂的结构简式为 。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成
。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成 。请回答下列问题:
。请回答下列问题:(1)下列说法正确的是_______(填序号)。
| A.碳铂分子中有一个手性碳原子 |
| B.反铂属于极性分子 |
| C.碳铂的中心原子铂的配位数为4 |
D. 中 中 的H原子与Pt形成配位键 的H原子与Pt形成配位键 |
 键的数目为
键的数目为(3)顺铂和反铂的物理性质有很大差异,其中只有
(4)乙烯酮分子中碳原子的杂化类型为
 ),双乙烯酮分子中含有的
),双乙烯酮分子中含有的 键和
键和 键的数目之比为
键的数目之比为(5)由于氢键的存在,乙酸分子间也可形成二聚体(含八元环),该二聚体的结构为
您最近一年使用:0次
名校
解题方法
3 . 金属钛(22Ti)及其化合物广泛应用于航空航天,被称为“未来世界的金属”。
(1)按电子排布Ti元素在元素周期表分区中属于___ 区元素,钛元素基态原子未成对电子数为___ 个。
(2)某含钛化合物的化学式为[TiCl(H2O)5]Cl2•H2O,化合物中含有的化学键类型是___ ,0.5mol该配合物中含有的σ键数目是___ 。
(3)二氧化钛是很好的催化剂,可以催化如下反应:
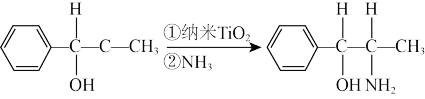
化合物甲中,sp2杂化的碳原子个数与sp3杂化的碳原子个数之比为___ ;化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为___ 。
(4)二氯二茂钛(IV)在金属有机合成中应用较广。其结构式如图所示。分子中的大π键可用符号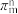 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为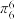 ),则二氯二茂钛(IV)中的大π键可表示为
),则二氯二茂钛(IV)中的大π键可表示为___ 。

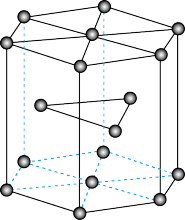
(5)金属钛晶体的一种原子堆积方式如图所示,这种堆积方式称为___ 。六棱柱底边边长为acm,阿伏加 德罗常数的值为NA,Ti的密度为___ g•cm-3。
(1)按电子排布Ti元素在元素周期表分区中属于
(2)某含钛化合物的化学式为[TiCl(H2O)5]Cl2•H2O,化合物中含有的化学键类型是
(3)二氧化钛是很好的催化剂,可以催化如下反应:

化合物甲中,sp2杂化的碳原子个数与sp3杂化的碳原子个数之比为
(4)二氯二茂钛(IV)在金属有机合成中应用较广。其结构式如图所示。分子中的大π键可用符号
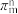 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为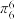 ),则二氯二茂钛(IV)中的大π键可表示为
),则二氯二茂钛(IV)中的大π键可表示为
(5)金属钛晶体的一种原子堆积方式如图所示,这种堆积方式称为

您最近一年使用:0次
2014高三·全国·专题练习
名校
解题方法
4 . A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是_______ (用对应的元素符号表示);基态D原子的电子排布式为______ 。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取_____ 杂化;BC3-的立体构型为______ (用文字描述)。
(3)1mol AB-中含有的π键个数为______ 。
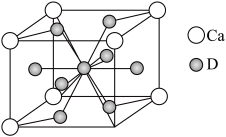
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比______ 。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________ (填数值);氢在合金中的密度为________ (保留2位有效数字)。
(1)A、B、C的第一电离能由小到大的顺序是
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取
(3)1mol AB-中含有的π键个数为
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=
您最近一年使用:0次
2019-12-08更新
|
181次组卷
|
12卷引用:【全国百强校】重庆市第一中学校2019届高三上学期期中考试理科综合化学试题
【全国百强校】重庆市第一中学校2019届高三上学期期中考试理科综合化学试题(已下线)2014年高考化学指导冲关 第13练物质结构与性质练习卷(已下线)2014届高考化学二轮专题冲刺第16讲 物质结构与性质练习卷(已下线)2014高考名师推荐化学--预测172016届四川省新津中学高三下学期入学考试化学试卷2018版化学(苏教版)高考总复习专题十一课时跟踪训练--微粒间作用力与物质性质【市级联考】湖北省鄂州市2019届高三上学期期中考试理科综合化学试题(已下线)第11章 单元测试(测)-《2020年高考一轮复习讲练测》江西省临川一中2020届高三上学期第一次联考化学试题广东省梅州市五华县2020届高三上学期期末质检理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)第十一章 能力提升检测卷-2021年高考化学一轮复习讲练测
名校
解题方法
5 . 化学与生活密切相关。
I. K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)基态Cr 原子的价电子轨道表达式为_________________ 。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________ ,碳原子的轨道杂化类型为_____ ,所含σ键与π键的数目之比为_______ 。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为_________________________ 。
II. ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4)Fe[Zn(OH)Cl2]2的水溶液中不存在的微粒间作用力有____________ (填选项字母);溶液中[Zn(OH)Cl2]—的结构式为_____________________ 。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。
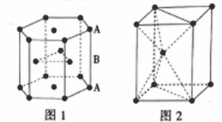
(5)锌的堆积方式为_____________________ ,配位数为_______ 。
(6)若锌原子的半径为a pm,阿伏伽德罗常数的值为NA,则锌晶体的密度为_______ g/cm3 (用含a的代数式表示)。
I. K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH
 Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)(1)基态Cr 原子的价电子轨道表达式为
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为
II. ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4)Fe[Zn(OH)Cl2]2的水溶液中不存在的微粒间作用力有
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。

(5)锌的堆积方式为
(6)若锌原子的半径为a pm,阿伏伽德罗常数的值为NA,则锌晶体的密度为
您最近一年使用:0次
2017-05-08更新
|
373次组卷
|
3卷引用:【全国百强校】重庆南开中学2019届高三下学期适应性考试理科综合化学试题



