名校
1 . 反应 可用于冶金。设
可用于冶金。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 可用于冶金。设
可用于冶金。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.2.0g 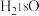 与 与 的混合物中所含质子数与中子数均为 的混合物中所含质子数与中子数均为 |
B.100mL 1 NaCN溶液中阴离子数为0.1 NaCN溶液中阴离子数为0.1 |
C.1mol 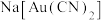 中含 中含 键数目为6 键数目为6 |
D.该反应消耗22.4L  ,转移电子数为4 ,转移电子数为4 |
您最近一年使用:0次
2024-03-26更新
|
436次组卷
|
4卷引用:江西省南昌市2024届高三下学期第三次模拟测试化学试题
名校
解题方法
2 . 碳是一种很常见的元素,它能形成多种物质。
(1)碳与铁可以形成合金。基态碳原子的价电子排布图为___________ ;基态铁原子核外共有___________ 种不同空间运动状态的电子。
(2)碳与其他元素一起能形成多种酸或酸根。
① 的空间结构是
的空间结构是___________ 。
②类卤素 分子中σ键与π键的数目比
分子中σ键与π键的数目比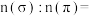
___________ , 对应的酸有两种,理论上硫氰酸(
对应的酸有两种,理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸(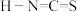 )的沸点,其原因是
)的沸点,其原因是___________ 。
(3)碳也可以形成多种有机化合物。吡咯( )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为___________ ;分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则吡咯中的大π键应表示为
),则吡咯中的大π键应表示为___________ 。
(1)碳与铁可以形成合金。基态碳原子的价电子排布图为
(2)碳与其他元素一起能形成多种酸或酸根。
①
 的空间结构是
的空间结构是②类卤素
 分子中σ键与π键的数目比
分子中σ键与π键的数目比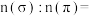
 对应的酸有两种,理论上硫氰酸(
对应的酸有两种,理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸(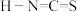 )的沸点,其原因是
)的沸点,其原因是(3)碳也可以形成多种有机化合物。吡咯(
 )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则吡咯中的大π键应表示为
),则吡咯中的大π键应表示为
您最近一年使用:0次
2023-09-03更新
|
194次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
3 . 利用γ-丁内酯制备四氢呋喃,反应过程中伴有生成1-丁醇的副反应,涉及反应如下:
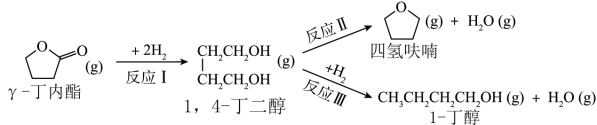
已知:反应Ⅰ为快速反应,反应Ⅱ、Ⅲ为慢速反应。在493K、3.0×103kPa的高压H2氛围下(H2压强近似等于总压),以5.0×10-3molγ-丁内酯为初始原料,x(γ-丁内酯)和x(1,4-丁二醇)随时间t变化关系如图所示[x(i)表示某物种i的物质的量与除H2外其它各物种总物质的量之比]。下列说法正确的是


已知:反应Ⅰ为快速反应,反应Ⅱ、Ⅲ为慢速反应。在493K、3.0×103kPa的高压H2氛围下(H2压强近似等于总压),以5.0×10-3molγ-丁内酯为初始原料,x(γ-丁内酯)和x(1,4-丁二醇)随时间t变化关系如图所示[x(i)表示某物种i的物质的量与除H2外其它各物种总物质的量之比]。下列说法正确的是

| A.γ-丁内酯分子中σ键与π键数目之比为6∶1 |
| B.生成四氢呋喃的速率主要决定于反应Ⅰ |
| C.t1时刻x(H2O)=0.08 |
| D.增大H2的压强一定有利于提高四氢呋喃产率 |
您最近一年使用:0次
解题方法
4 . 腺嘌呤核苷和腺嘌呤核苷酸是生产核酸类药物的中间体,结构如图所示。

(1)磷酸分子中σ键与π键之比为___________ 。
(2)已知基态N、O原子的第一电离能(I1)分别为1402kJ/mol和1314kJ/mol,I1(N)>I1(O),原因是___________ 。
(3)下列不同状态的碳原子中,失去一个电子需要吸收能量最多的是___________(填标号)。
(4)从实验测得不同物质中氧-氧之间的键长和键能的数据:
说明同种原子形成共价键,___________ ,键长越长,键能越小。
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm,沿Z轴从上往下俯视的晶胞投影图如下图所示:

①若图中原子1的分数坐标是( ,
, ,
, ),则原子5的分数坐标是
),则原子5的分数坐标是___________ 。
②晶胞结构中原子1、5之间的距离为___________ cm。(用含a的式子表示)
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为___________  (用含M的式子表示)
(用含M的式子表示)

(1)磷酸分子中σ键与π键之比为
(2)已知基态N、O原子的第一电离能(I1)分别为1402kJ/mol和1314kJ/mol,I1(N)>I1(O),原因是
(3)下列不同状态的碳原子中,失去一个电子需要吸收能量最多的是___________(填标号)。
A. | B.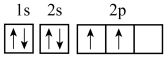 |
C. | D.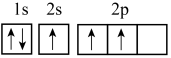 |
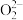 | O2 | |
键长(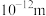 ) ) | 149 | 121 |
键能( ) ) | 126 | 494 |
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm,沿Z轴从上往下俯视的晶胞投影图如下图所示:

①若图中原子1的分数坐标是(
 ,
, ,
, ),则原子5的分数坐标是
),则原子5的分数坐标是②晶胞结构中原子1、5之间的距离为
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为
 (用含M的式子表示)
(用含M的式子表示)
您最近一年使用:0次
2023-06-28更新
|
115次组卷
|
2卷引用:江西省上饶市2022-2023学年高二下学期期末教学质量测试化学试题
名校
解题方法
5 . 东南大学某课题组合成了一种新型具有平面分子结构的醌类聚合物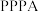 ,
,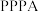 可作为有机锌离子电池的正极材料。下列叙述正确的是
可作为有机锌离子电池的正极材料。下列叙述正确的是

已知: 作该反应的催化剂,
作该反应的催化剂, 升华温度为178℃,
升华温度为178℃, 的熔点为801℃。
的熔点为801℃。
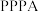 ,
,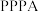 可作为有机锌离子电池的正极材料。下列叙述正确的是
可作为有机锌离子电池的正极材料。下列叙述正确的是
已知:
 作该反应的催化剂,
作该反应的催化剂, 升华温度为178℃,
升华温度为178℃, 的熔点为801℃。
的熔点为801℃。A.吩嗪和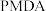 是 是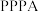 的链节 的链节 |
| B.为了提高反应速率,可将反应温度由150℃升至160℃ |
C.上述反应中,断裂了 键和 键和 键,也形成了 键,也形成了 键和 键和 键 键 |
D. 吩嗪和 吩嗪和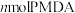 完全合成 完全合成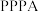 时,生成 时,生成 水 水 |
您最近一年使用:0次
2023-04-28更新
|
706次组卷
|
3卷引用:江西省高安市灰埠中学2022-2023学年高二下学期5月期中考试化学试题
名校
解题方法
6 . 材料是人类文明进步的阶梯,第IIIA、IVA、VA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)根据价层电子对互斥理论, 、
、 、
、 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是_______ ,已知 与
与 互为等电子体,推算HCN分子中σ键与π键的数目比为
互为等电子体,推算HCN分子中σ键与π键的数目比为_______ 。
(2)M与Ga位于同周期, 的一种配合物组成为
的一种配合物组成为 。
。
①下列有关 、
、 的说法正确的是
的说法正确的是_______ (填字母)。
a.分子空间构型相同 b.中心原子杂化类型相同 c.键角大小相同
② 配体是
配体是_______ 。
③配合物T与 组成元素相同,中心离子的配位数相同。1moT溶于水,加入足量
组成元素相同,中心离子的配位数相同。1moT溶于水,加入足量 溶液只生成2molAgCl沉淀,则T的化学式为
溶液只生成2molAgCl沉淀,则T的化学式为_______ 。
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属农面的保护层,其结构与金刚石类似,晶胞结构如图所示,磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______ 。
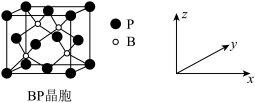
(4)已知晶胞中B与P原子最短距离为a pm,则磷化硼晶体的密度是_______  (仅列式不计算)。
(仅列式不计算)。
(1)根据价层电子对互斥理论,
 、
、 、
、 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是 与
与 互为等电子体,推算HCN分子中σ键与π键的数目比为
互为等电子体,推算HCN分子中σ键与π键的数目比为(2)M与Ga位于同周期,
 的一种配合物组成为
的一种配合物组成为 。
。①下列有关
 、
、 的说法正确的是
的说法正确的是a.分子空间构型相同 b.中心原子杂化类型相同 c.键角大小相同
②
 配体是
配体是③配合物T与
 组成元素相同,中心离子的配位数相同。1moT溶于水,加入足量
组成元素相同,中心离子的配位数相同。1moT溶于水,加入足量 溶液只生成2molAgCl沉淀,则T的化学式为
溶液只生成2molAgCl沉淀,则T的化学式为(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属农面的保护层,其结构与金刚石类似,晶胞结构如图所示,磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是

(4)已知晶胞中B与P原子最短距离为a pm,则磷化硼晶体的密度是
 (仅列式不计算)。
(仅列式不计算)。
您最近一年使用:0次
2022-12-27更新
|
197次组卷
|
2卷引用:江西省抚州市资溪县第一中学2022-2023学年高二下学期5月期中考试化学试题
7 . 铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
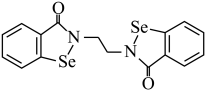
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态 原子的核外电子排布式为
原子的核外电子排布式为
_______ ;
②该新药分子中有_______ 种不同化学环境的C原子;
③比较键角大小:气态 分子
分子_______  离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_______ 。
(2)富马酸亚铁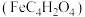 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:
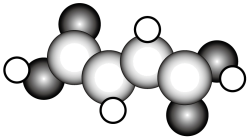
①富马酸分子中 键与
键与 键的数目比为
键的数目比为_______ ;
②富马酸亚铁中各元素的电负性由大到小的顺序为_______ 。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将
,将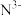 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:

①产物中N原子的杂化轨道类型为_______ ;
②与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填化学式)。
(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
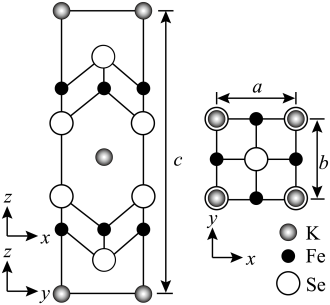
①该超导材料的最简化学式为_______ ;
②Fe原子的配位数为_______ ;
③该晶胞参数 、
、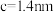 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______ 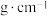 (列出计算式)。
(列出计算式)。
 )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①基态
 原子的核外电子排布式为
原子的核外电子排布式为
②该新药分子中有
③比较键角大小:气态
 分子
分子 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(2)富马酸亚铁
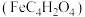 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中
 键与
键与 键的数目比为
键的数目比为②富马酸亚铁中各元素的电负性由大到小的顺序为
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化
 ,将
,将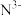 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:
①产物中N原子的杂化轨道类型为
②与
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数
 、
、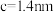 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为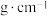 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2022-06-10更新
|
8155次组卷
|
10卷引用:江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题
江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题2022年新高考湖南化学高考真题(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题19 物质结构与性质综合题-备战2023年高考化学母题题源解密(广东卷)(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
名校
解题方法
8 . 铁在成人体中的含量约为4~5g,是入体必需的微量元素中含量最多的一种,回答下列问题:
(1)基态Fe原子的核外电子排布式为_______ ,用原子结构知识解释Fe2+易被氧化为Fe3+的原因_______ 。
(2)甘氨酸亚铁[(H2NCH2COO)2Fe]的主要生理功能是预防和改善缺铁性贫血。
①甘氨酸H2NCH2COOH中C原子的杂化形式为_______ ,C、N、O三种原子第一电离能由小到大的顺序是_______ 。
②甘氨酸易溶于水,原因为_______ 。
(3)五羰基合铁[Fe(CO)5]的配位体是_______ ;已知配位原子是C而不是O,其可能的原因是_______ 。
(4)已知Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓,利用该离子方程式可以检验溶液中的Fe3+。[Fe(CN)6]4-中σ键、π键数目之比为_______ 。
(5)Fe3O4晶体的晶胞如下图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中。
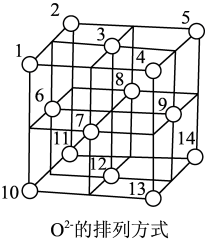
①O2-周围紧邻的O2-数目为_______ 。
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为___ g·cm-3(用含a和NA的代数式表示)。
③晶体中正四面体空隙数与正八面体空隙数之比为_______ 。
(1)基态Fe原子的核外电子排布式为
(2)甘氨酸亚铁[(H2NCH2COO)2Fe]的主要生理功能是预防和改善缺铁性贫血。
①甘氨酸H2NCH2COOH中C原子的杂化形式为
②甘氨酸易溶于水,原因为
(3)五羰基合铁[Fe(CO)5]的配位体是
(4)已知Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓,利用该离子方程式可以检验溶液中的Fe3+。[Fe(CN)6]4-中σ键、π键数目之比为
(5)Fe3O4晶体的晶胞如下图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中。

①O2-周围紧邻的O2-数目为
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为
③晶体中正四面体空隙数与正八面体空隙数之比为
您最近一年使用:0次
2022-04-22更新
|
422次组卷
|
2卷引用:江西省上饶市第一中学2022届高三下学期5月模拟考理科综合化学试题
2014高三·全国·专题练习
名校
解题方法
9 . A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是_______ (用对应的元素符号表示);基态D原子的电子排布式为______ 。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取_____ 杂化;BC3-的立体构型为______ (用文字描述)。
(3)1mol AB-中含有的π键个数为______ 。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比______ 。
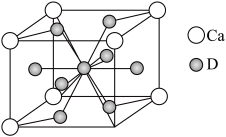
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________ (填数值);氢在合金中的密度为________ (保留2位有效数字)。
(1)A、B、C的第一电离能由小到大的顺序是
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取
(3)1mol AB-中含有的π键个数为
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=
您最近一年使用:0次
2019-12-08更新
|
181次组卷
|
12卷引用:江西省临川一中2020届高三上学期第一次联考化学试题
江西省临川一中2020届高三上学期第一次联考化学试题(已下线)2014年高考化学指导冲关 第13练物质结构与性质练习卷(已下线)2014届高考化学二轮专题冲刺第16讲 物质结构与性质练习卷(已下线)2014高考名师推荐化学--预测172016届四川省新津中学高三下学期入学考试化学试卷2018版化学(苏教版)高考总复习专题十一课时跟踪训练--微粒间作用力与物质性质【全国百强校】重庆市第一中学校2019届高三上学期期中考试理科综合化学试题【市级联考】湖北省鄂州市2019届高三上学期期中考试理科综合化学试题(已下线)第11章 单元测试(测)-《2020年高考一轮复习讲练测》广东省梅州市五华县2020届高三上学期期末质检理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)第十一章 能力提升检测卷-2021年高考化学一轮复习讲练测
名校
解题方法
10 . H、C、N、O、Na、Fe、Cu是常见的七种元素。
(1)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是____________ 。
(2)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是______ (填写序号)。
a.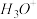 b.
b. 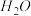 c.
c. 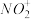 d.
d. 
(3)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为___________ ,1个分子中含有_________ 个π键。
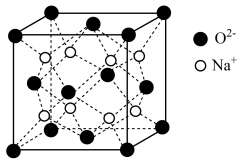
(4)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为_____________ 。已知该晶胞的密度为ρg/cm3,阿伏伽德罗常数为NA,求晶胞边长
_______ cm。(用含ρ、NA的代数式表示)
(1)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是
(2)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是
a.
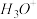 b.
b. 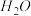 c.
c. 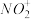 d.
d. 
(3)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为
(4)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为


您最近一年使用:0次
2017-04-17更新
|
320次组卷
|
3卷引用:2017届江西省五市八校高三下学期第二次联考理综化学试卷



