名校
解题方法
1 . 磷、碳、氢、氧等非金属及其化合物用途广泛。回答下列问题:
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为_______ 。(用NA表示阿伏伽德罗常数的值)
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为_______ 。
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为_______ ,产生的阳离子的空间结构为_______ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 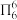 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为_______ ,一定在同一平面上的原子有_______ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,_______ 。
(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。
①该化合物的化学式为_______ 。
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为_______ pm;该晶体的密度为_______ g•cm-3(阿伏加德罗常数为NA)
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 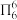 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。

①该化合物的化学式为
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为
您最近一年使用:0次
2 . 设NA为阿伏加德罗常数的值。下列说法正确的是
| A.24g乙烯和丙烯的混合气体中p-pσ键数目为2NA |
B.1L1mol/L氯化铵溶液中NH 和H+数目之和为NA 和H+数目之和为NA |
| C.2molNO与1molO2在密闭容器中充分反应后的分子数为2NA |
| D.标准状况下,11.2LCH4与22.4LCl2反应后分子总数为1.5NA |
您最近一年使用:0次
2023-05-26更新
|
1244次组卷
|
4卷引用:湖北省武汉市2023届高三5月模拟训练(武汉5调) 化学试题
湖北省武汉市2023届高三5月模拟训练(武汉5调) 化学试题(已下线)第03练 阿伏加德罗常数(NA)及其应用-2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点巩固卷01 化学计量(2大考点42题)?-2024年高考化学一轮复习考点通关卷(新高考通用)江苏省徐州部分学校2023-2024学年高三上学期9月开学考试化学试题
名校
解题方法
3 . 下列说法正确的是
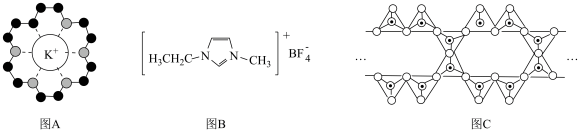

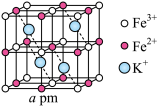
A.图A中,18-冠-6中O原子电负性大,带负电荷,通过离子键与 作用,体现了超分子“分子识别”的特征 作用,体现了超分子“分子识别”的特征 |
B.图B物质相较 摩尔质量更大,具更高的熔沸点 摩尔质量更大,具更高的熔沸点 |
| C.图B中,1mol该物质含有20mol σ键 |
D.图C中,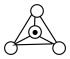 表示硅氧四面体,则该硅酸盐结构的通式为 表示硅氧四面体,则该硅酸盐结构的通式为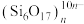 |
您最近一年使用:0次
2023-04-27更新
|
397次组卷
|
3卷引用:考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)浙江省稽阳联谊学校2022-2023学年高三下学期4月联考化学试题山东省青岛一中2023-2024学年高二下学期第二次月考化学试卷
名校
解题方法
4 . 氧钒(IV)碱式碳酸铵为紫色晶体,难溶于水,是制备热敏材料 的原料,其化学式为
的原料,其化学式为 。实验室以
。实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:

已知:+4价钒在弱酸性条件下具有还原性,能被 氧化。
氧化。
(1)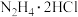 为离子化合物,
为离子化合物, 中含有的σ键数目为
中含有的σ键数目为_______ 。
(2)步骤1中生成 的同时生成一种无色无污染的气体,该反应的化学方程式为
的同时生成一种无色无污染的气体,该反应的化学方程式为_______ 。
(3)步骤2可在下图装置(气密性良好)中进行。
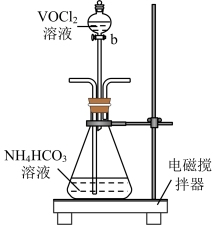
制备过程中,需向锥形瓶中通入 ,作用是
,作用是_______ ,所得紫色晶体残留的杂质离子主要为_______ 。
(4)步骤3洗涤晶体时需用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,选择饱和
溶液洗涤3次,再用无水乙醇洗涤2次,选择饱和 溶液的原因是
溶液的原因是_______ 。
(5)已知:①去除溶液中 可依次加入尿素溶液(还原
可依次加入尿素溶液(还原 )、亚硝酸钠溶液(氧化尿素)。
)、亚硝酸钠溶液(氧化尿素)。
②滴定反应: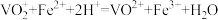 。
。
补充完整测定氧钒(Ⅳ)碱式碳酸按晶体中钒的含量的实验方案:称量5.1000g样品于锥形瓶中,_______ 。(实验中须使用的试剂是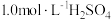 溶液、
溶液、 溶液、尿素溶液、亚硝酸钠溶液、0.0800mol/L的
溶液、尿素溶液、亚硝酸钠溶液、0.0800mol/L的 标准溶液,滴定终点的现象描述不作要求)
标准溶液,滴定终点的现象描述不作要求)
 的原料,其化学式为
的原料,其化学式为 。实验室以
。实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
已知:+4价钒在弱酸性条件下具有还原性,能被
 氧化。
氧化。(1)
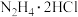 为离子化合物,
为离子化合物, 中含有的σ键数目为
中含有的σ键数目为(2)步骤1中生成
 的同时生成一种无色无污染的气体,该反应的化学方程式为
的同时生成一种无色无污染的气体,该反应的化学方程式为(3)步骤2可在下图装置(气密性良好)中进行。

制备过程中,需向锥形瓶中通入
 ,作用是
,作用是(4)步骤3洗涤晶体时需用饱和
 溶液洗涤3次,再用无水乙醇洗涤2次,选择饱和
溶液洗涤3次,再用无水乙醇洗涤2次,选择饱和 溶液的原因是
溶液的原因是(5)已知:①去除溶液中
 可依次加入尿素溶液(还原
可依次加入尿素溶液(还原 )、亚硝酸钠溶液(氧化尿素)。
)、亚硝酸钠溶液(氧化尿素)。②滴定反应:
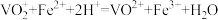 。
。补充完整测定氧钒(Ⅳ)碱式碳酸按晶体中钒的含量的实验方案:称量5.1000g样品于锥形瓶中,
 溶液、
溶液、 溶液、尿素溶液、亚硝酸钠溶液、0.0800mol/L的
溶液、尿素溶液、亚硝酸钠溶液、0.0800mol/L的 标准溶液,滴定终点的现象描述不作要求)
标准溶液,滴定终点的现象描述不作要求)
您最近一年使用:0次
5 . 铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
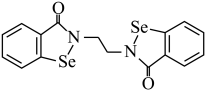
①基态 原子的核外电子排布式为
原子的核外电子排布式为
_______ ;
②该新药分子中有_______ 种不同化学环境的C原子;
③比较键角大小:气态 分子
分子_______  离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_______ 。
(2)富马酸亚铁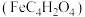 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:
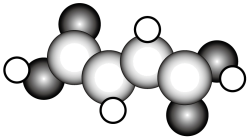
①富马酸分子中 键与
键与 键的数目比为
键的数目比为_______ ;
②富马酸亚铁中各元素的电负性由大到小的顺序为_______ 。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将
,将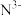 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:

①产物中N原子的杂化轨道类型为_______ ;
②与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填化学式)。
(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
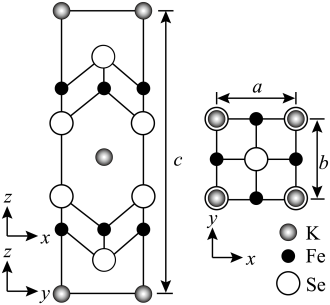
①该超导材料的最简化学式为_______ ;
②Fe原子的配位数为_______ ;
③该晶胞参数 、
、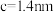 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______ 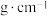 (列出计算式)。
(列出计算式)。
 )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①基态
 原子的核外电子排布式为
原子的核外电子排布式为
②该新药分子中有
③比较键角大小:气态
 分子
分子 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(2)富马酸亚铁
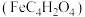 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中
 键与
键与 键的数目比为
键的数目比为②富马酸亚铁中各元素的电负性由大到小的顺序为
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化
 ,将
,将 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:
①产物中N原子的杂化轨道类型为
②与
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数
 、
、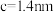 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为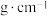 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2022-06-10更新
|
8155次组卷
|
10卷引用:第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)2022年新高考湖南化学高考真题(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)专题19 物质结构与性质综合题-备战2023年高考化学母题题源解密(广东卷)江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题
解题方法
6 . 过渡金属在生产、生活、科技等方面有着广泛的应用。例如仿生簇化合物Mn4XO4(X=Ca2+/Y3+/Gd3+)有望为实现利用太阳能和水获取清洁能源(氢能)开辟新途径,MnOx·Na2WO4·SiO2、钴(Co)的合金及其化合物材料等广泛应用于化工催化剂等领域。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为_______ 。
(2)基态Co原子核外有_______ 种运动状态不同的电子,其3d能级上有_______ 对成对电子。
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是_______ (填元素符号)。已知:[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-。[Co(CN)6]4-中含有σ键与π键的数目之比为_______ ,[Co(CN)6]3-中C的杂化方式为_______ 。
(4)[Mn(NH3)2]2+中配体分子的立体构型是_______ 。[Mn(NH3)2]2+中键角∠HNH_______ (填“大于” 、“小于”或“等于”)NH3中键角∠HNH。
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是_______ 。
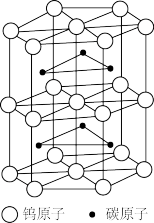
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是_______ ;已知:碳化钨晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,六棱柱高为a cm,则底边长为_______ (用含ρ、a、N的表达式表示)nm。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为
(2)基态Co原子核外有
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是
(4)[Mn(NH3)2]2+中配体分子的立体构型是
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是

您最近一年使用:0次
2022-05-27更新
|
410次组卷
|
5卷引用:河北省秦皇岛市2022届高三三模化学试题
河北省秦皇岛市2022届高三三模化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编河南省2022届高三下学期仿真模拟大联考理科综合化学试题(已下线)新疆博乐高级中学2022届高三第一次诊断性测试理科综合化学试卷广东省部分学校2022届高三下学期高考冲刺化学试题
名校
解题方法
7 . 全球首次在350公里时速的奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有_______ 种,若其电子排布式表示为[ Ne]3s2 违背了
违背了_______ 。
(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3_______ SiCl4(填“>”或“<”),与SiCl4互为等电子体的离子为_______ (任写1种即可)。已知电负性:H>Si,则SiHCl3充分水解的化学方程式为_______ 。
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是_______ (填字母标号)。
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度_______ (填“高”或“低”),解释原因_______ 。
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为_______ D,该氮化钛的密度_______ g· cm-3(列出计算式即可)。

(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有
 违背了
违背了(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为

您最近一年使用:0次
2022-04-14更新
|
1935次组卷
|
11卷引用:山西省临汾市2022届高考考前适应性训练考试(二)理科综合化学试题
山西省临汾市2022届高考考前适应性训练考试(二)理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(全国甲卷)北京市第二中学2022届高三下学期五月模拟考试化学试题广东省广州市第六中学2022届高三第三次模拟考试化学试题广西南宁市第二中学2021-2022学年高三下学期收网题理综化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题广东省茂名市普通高中毕业班2022届高三下学期模拟考试化学试题(已下线)第21练 新高考模式综合练(广东卷)-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
2021高三·全国·专题练习
解题方法
8 . 铬的同位素有 Cr、
Cr、 Cr、
Cr、 Cr、
Cr、 Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态 Cr的价层电子排布图为
Cr的价层电子排布图为___________ 。
(2)交警用“酒精仪”查酒驾,其化学反应原理为2K2Cr2O7+3CH3CH2OH+8H2SO4―→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O。
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),主要原因是___________ 。
②CH3COOH分子中碳原子的杂化类型是___________ ;CH3COOH分子中σ键和π键的数目之比为___________ 。
③K2SO4晶体中阴离子的立体构型是___________ 。
该反应中,只含极性键的极性分子有___________ (填分子式)。
(3)CrF3晶体、CrBr3晶体的熔点分别为1 100 ℃以上、79 ℃,其可能的原因是___________ 。
(4)晶体铬的晶胞结构如图所示,其堆积模型为___________ ;铬原子的配位数为___________ 。

 Cr、
Cr、 Cr、
Cr、 Cr、
Cr、 Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:(1)基态
 Cr的价层电子排布图为
Cr的价层电子排布图为(2)交警用“酒精仪”查酒驾,其化学反应原理为2K2Cr2O7+3CH3CH2OH+8H2SO4―→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O。
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),主要原因是
②CH3COOH分子中碳原子的杂化类型是
③K2SO4晶体中阴离子的立体构型是
该反应中,只含极性键的极性分子有
(3)CrF3晶体、CrBr3晶体的熔点分别为1 100 ℃以上、79 ℃,其可能的原因是
(4)晶体铬的晶胞结构如图所示,其堆积模型为

您最近一年使用:0次
名校
9 . 富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图,下列说法错误的是
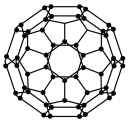

| A.分子中碳原子轨道的杂化类型为sp2杂化 |
| B.1molC60分子中σ键的数目为90NA |
| C.1个C60分子中含有20个五边形和12个六边形 |
| D.C60分子晶胞是分子密堆积 |
您最近一年使用:0次
2021-09-09更新
|
1640次组卷
|
4卷引用:河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题
名校
解题方法
10 . 12月 17日凌晨,嫦娥五号完成“ 挖土” 之旅返回地球。查阅资料,月球玄武岩是构成月球的岩石之一,主要由辉石(主要成分硅酸盐)和钛铁矿(主要成分 FeTiO3)等组成。回答下列问题:
(1)基态铁原子的价电子排布式为:______ 。
(2)与 Fe同周期,且最外层电子数相同的主族元素是______ (填元素符号)。
(3)基态 Ti原子核外电子占据的最高能层符号为______ ;其最外层电子的电子云轮廓图为______ 。
(4)1molFe3[Fe(CN)6]2中含有 σ键数为______ ,[Fe(CN)6]3-中配体为______ ,其中 C原子的杂化轨道类型为______ ,H、C、N、Si四种元素的电负性由大到小的顺序为______ 。
(5)FeTiO3的结构如图 1所示,其中由 O围成的______ (填“ 四面体空隙” 或“ 八面体空隙” )被 Fe占据。在图 2中画出 FeTiO3结构的另一种表示______ (要求:Fe处于晶胞的顶点),Ti的配位数为______ 。
(6)已知该晶胞的密度为 ρg/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数 a=______ pm。(列出计算表达式)
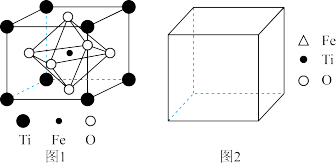
(1)基态铁原子的价电子排布式为:
(2)与 Fe同周期,且最外层电子数相同的主族元素是
(3)基态 Ti原子核外电子占据的最高能层符号为
(4)1molFe3[Fe(CN)6]2中含有 σ键数为
(5)FeTiO3的结构如图 1所示,其中由 O围成的
(6)已知该晶胞的密度为 ρg/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数 a=

您最近一年使用:0次
2021-03-14更新
|
854次组卷
|
3卷引用:河南省洛阳市2021届高三3月调研考试理综化学试题
河南省洛阳市2021届高三3月调研考试理综化学试题湖南省娄底市第五中学2021-2022学年高三下学期期中考试化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)



