名校
解题方法
1 . 二氯化一氯五氨合钴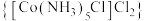 可用作聚氯乙烯的染色剂和稳定剂。已知:
可用作聚氯乙烯的染色剂和稳定剂。已知: 不溶于水和乙醇;
不溶于水和乙醇; 是粉红色不溶于水的固体;
是粉红色不溶于水的固体; 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。
Ⅰ.制备
某实验小组利用以下装置和流程制备 。
。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。
步骤ⅲ,待溶液中停止产生气泡后,缓慢加入 浓盐酸,在
浓盐酸,在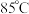 水浴中加热
水浴中加热 ,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。
,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。
Ⅱ.产品结构分析
(2) 中存在的化学键有
中存在的化学键有_______ (填标号);
A.离子键 B.范德华力 C.极性共价键 D.非极性共价键 E.配位键 F.氢键
(3) 中含
中含 键的数目为
键的数目为_______ 。
Ⅲ.实验探究
(4)实验小组在制备过程中发现 溶液中直接加入
溶液中直接加入 不被氧化,据此认为加入浓氨水和氯化铵对
不被氧化,据此认为加入浓氨水和氯化铵对 的氧化产生了影响,提出以下猜想并设计实验验证
的氧化产生了影响,提出以下猜想并设计实验验证
猜想1:加入氯化铵溶液,增强了 的氧化性
的氧化性
猜想2:加入浓氨水形成配合物,增强了 离子的还原性
离子的还原性
实验结论:猜想1不合理,猜想2合理。
①a是_______ ,b是_______ ;
②步骤ⅰ中氯化铵的作用是_______ 。
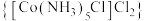 可用作聚氯乙烯的染色剂和稳定剂。已知:
可用作聚氯乙烯的染色剂和稳定剂。已知: 不溶于水和乙醇;
不溶于水和乙醇; 是粉红色不溶于水的固体;
是粉红色不溶于水的固体; 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。Ⅰ.制备

某实验小组利用以下装置和流程制备
 。
。
 ,发生反应的离子方程式为
,发生反应的离子方程式为步骤ⅲ,待溶液中停止产生气泡后,缓慢加入
 浓盐酸,在
浓盐酸,在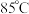 水浴中加热
水浴中加热 ,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。
,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。Ⅱ.产品结构分析
(2)
 中存在的化学键有
中存在的化学键有A.离子键 B.范德华力 C.极性共价键 D.非极性共价键 E.配位键 F.氢键
(3)
 中含
中含 键的数目为
键的数目为Ⅲ.实验探究
(4)实验小组在制备过程中发现
 溶液中直接加入
溶液中直接加入 不被氧化,据此认为加入浓氨水和氯化铵对
不被氧化,据此认为加入浓氨水和氯化铵对 的氧化产生了影响,提出以下猜想并设计实验验证
的氧化产生了影响,提出以下猜想并设计实验验证猜想1:加入氯化铵溶液,增强了
 的氧化性
的氧化性猜想2:加入浓氨水形成配合物,增强了
 离子的还原性
离子的还原性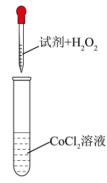
| 实验编号 | 试剂 | 现象 |
| 1 | 0.5mL水 | 无明显变化 |
| 2 | a | 无明显变化 |
| 3 | b | 溶液变为深红色,且出现棕褐色沉淀 |
①a是
②步骤ⅰ中氯化铵的作用是
您最近一年使用:0次
名校
2 . 氟利昂—11(CFCl3)破坏臭氧层的反应过程如图所示。设 NA为阿伏加德罗常数的值,下列说法正确的是

| A.0.5mol由 CFCl3 、•CFCl2 组成的混合物中共价键的数目为2NA |
| B.1.6g由 O2和 O3组成的混合气体中含有的原子总数为0.1NA |
| C.标准状况下,1.12L18O3中含有的中子总数为1.2NA |
| D.1mol O3中含孤电子对数为6NA |
您最近一年使用:0次
2024-05-02更新
|
127次组卷
|
2卷引用:福建省泉州市泉港区第二中学2024届高三下学期第一次模拟预测化学试题
名校
解题方法
3 . 我国科学家利用锰簇催化剂(Mn4CaOx,x代表氧原子数)解密光合作用。锰簇的可逆结构异构化反应如图:
(1)基态钙原子中能量最高的电子所占据原子轨道的电子云轮廓图为_______ 形。
(2)已知:在元素周期表中Mn、Cr相邻,第二电离能与第一电离能之差较小的是_______ (填“Mn”或“Cr”),理由是_______ 。
(3)在上述异构化反应中,1molA中由Mn形成的σ键有_______ mol。
(4)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示:_______ ,距离Mn原子最近的Mn原子有_______ 个。
②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号S原子坐标为(0,0,0),3号S原子坐标为(1,1,1),则2号S原子坐标为_______ 。
③已知:MnS晶体的密度为ρg·cm3, 为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为_______ pm(列出计算式即可)。

(1)基态钙原子中能量最高的电子所占据原子轨道的电子云轮廓图为
(2)已知:在元素周期表中Mn、Cr相邻,第二电离能与第一电离能之差较小的是
(3)在上述异构化反应中,1molA中由Mn形成的σ键有
(4)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示:

②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号S原子坐标为(0,0,0),3号S原子坐标为(1,1,1),则2号S原子坐标为
③已知:MnS晶体的密度为ρg·cm3,
 为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
您最近一年使用:0次
名校
解题方法
4 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为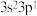 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
名校
解题方法
5 .  (铁氰化钾)常用于检验
(铁氰化钾)常用于检验 。某小组对
。某小组对 展开探究:
展开探究:
实验(一)制备 。
。
实验室用 氧化
氧化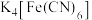 制备
制备 ,装置如图所示。
,装置如图所示。___________ 。
(2)理论上A中阴、阳两极产生气体的体积比为1:1,实验测得铜极、石墨极收集气体的体积比大于1:1(同温同压),其原因可能是___________ (答一条即可)。
实验(二)探究 的电离程度。
的电离程度。
【提出问题】 的阴离子团是否电离?
的阴离子团是否电离?
【提出假设】
假设1: 完全电离。
完全电离。
假设2: 部分电离。
部分电离。
假设3: 不电离。
不电离。
【设计实验】
【实验结论】
(3)实验结果: 。由此可知,假设
。由此可知,假设___________ (填“1”“2”或“3”)成立。用必要的化学用语和文字解释实验Ⅱ产生蓝色沉淀的原因:___________ 。
【交流反思】
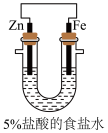
(4)利用如图装置探究牺牲阳极法,一段时间后,设计实验探究锌是否保护了铁:___________ 。
(5) (铁氰化钾)、
(铁氰化钾)、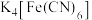 (亚铁氰化钾)是分析化学中两种常用的试剂。
(亚铁氰化钾)是分析化学中两种常用的试剂。
①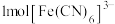 含
含___________  键。
键。
②配离子在水中的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为轨道的分裂能。由此可知, 的分裂能
的分裂能________ (填“大于”或“小于”) 。
。
 (铁氰化钾)常用于检验
(铁氰化钾)常用于检验 。某小组对
。某小组对 展开探究:
展开探究:实验(一)制备
 。
。实验室用
 氧化
氧化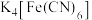 制备
制备 ,装置如图所示。
,装置如图所示。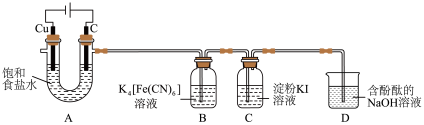
(2)理论上A中阴、阳两极产生气体的体积比为1:1,实验测得铜极、石墨极收集气体的体积比大于1:1(同温同压),其原因可能是
实验(二)探究
 的电离程度。
的电离程度。【提出问题】
 的阴离子团是否电离?
的阴离子团是否电离?【提出假设】
假设1:
 完全电离。
完全电离。假设2:
 部分电离。
部分电离。假设3:
 不电离。
不电离。【设计实验】
| 实验序号 | 操作及现象 |
| I | 在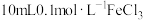 和 和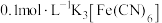 的混合溶液中插入一根无锈铁丝, 的混合溶液中插入一根无锈铁丝, 产生蓝色沉淀 产生蓝色沉淀 |
| Ⅱ | 在 溶液中插入一根无锈铁丝(与Ⅰ中相同), 溶液中插入一根无锈铁丝(与Ⅰ中相同), 产生蓝色沉淀 产生蓝色沉淀 |
(3)实验结果:
 。由此可知,假设
。由此可知,假设【交流反思】
(4)利用如图装置探究牺牲阳极法,一段时间后,设计实验探究锌是否保护了铁:
(5)
 (铁氰化钾)、
(铁氰化钾)、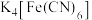 (亚铁氰化钾)是分析化学中两种常用的试剂。
(亚铁氰化钾)是分析化学中两种常用的试剂。①
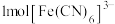 含
含 键。
键。②配离子在水中的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为轨道的分裂能。由此可知,
 的分裂能
的分裂能 。
。
您最近一年使用:0次
2024-02-02更新
|
307次组卷
|
2卷引用:福建省十一所学校2023-2024学年高三上学期期末联考化学试题
解题方法
6 . 铁、钴、镍并称铁系元素,性质具有相似性。
(1)基态钴原子的核外电子排布式为___________ 。
(2)①铁氰化钾 溶液可以检验
溶液可以检验 ,
, 中含有
中含有 键的数目为
键的数目为___________ (设 为阿伏加德罗常数的值),铁氰化钾晶体中各种粒子间的相互作用不包括
为阿伏加德罗常数的值),铁氰化钾晶体中各种粒子间的相互作用不包括___________ 。
a. 离子键 b. 共价键 c. 配位键 d. 金属键 e. 氢键 f. 范德华力
②向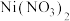 溶液中滴加氨水,刚开始时生成绿色
溶液中滴加氨水,刚开始时生成绿色 沉淀,当氨水过量时,沉淀会溶解,生成
沉淀,当氨水过量时,沉淀会溶解,生成 蓝色溶液,则
蓝色溶液,则 含有的
含有的 键的物质的量为
键的物质的量为___________ mol。
(3)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化。甲醛分子的空间结构为___________ ,碳原子的杂化类型为___________ 。
(4)NiO、FeO的晶体结构类型均与氯化钠的相同, 和
和 的离子半径分别为
的离子半径分别为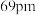 和
和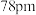 ,则熔点NiO
,则熔点NiO___________ (填“<”或“>”)FeO,判断依据是___________ 。
(5)某氮化铁的晶胞结构如图所示:

①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A为(0,0,0)、B为 ( ,
, ,
, )、C为(0,1,1),则D原子的坐标参数为
)、C为(0,1,1),则D原子的坐标参数为___________ 。
②若该晶体的密度是 ,则晶胞中两个距离最近的Fe原子的核间距为
,则晶胞中两个距离最近的Fe原子的核间距为___________ cm。(用含 的代数式表示,不必化简,设
的代数式表示,不必化简,设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
(1)基态钴原子的核外电子排布式为
(2)①铁氰化钾
 溶液可以检验
溶液可以检验 ,
, 中含有
中含有 键的数目为
键的数目为 为阿伏加德罗常数的值),铁氰化钾晶体中各种粒子间的相互作用不包括
为阿伏加德罗常数的值),铁氰化钾晶体中各种粒子间的相互作用不包括a. 离子键 b. 共价键 c. 配位键 d. 金属键 e. 氢键 f. 范德华力
②向
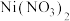 溶液中滴加氨水,刚开始时生成绿色
溶液中滴加氨水,刚开始时生成绿色 沉淀,当氨水过量时,沉淀会溶解,生成
沉淀,当氨水过量时,沉淀会溶解,生成 蓝色溶液,则
蓝色溶液,则 含有的
含有的 键的物质的量为
键的物质的量为(3)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化。甲醛分子的空间结构为
(4)NiO、FeO的晶体结构类型均与氯化钠的相同,
 和
和 的离子半径分别为
的离子半径分别为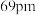 和
和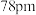 ,则熔点NiO
,则熔点NiO(5)某氮化铁的晶胞结构如图所示:

①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A为(0,0,0)、B为 (
 ,
, ,
, )、C为(0,1,1),则D原子的坐标参数为
)、C为(0,1,1),则D原子的坐标参数为②若该晶体的密度是
 ,则晶胞中两个距离最近的Fe原子的核间距为
,则晶胞中两个距离最近的Fe原子的核间距为 的代数式表示,不必化简,设
的代数式表示,不必化简,设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
解题方法
7 . 配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。_____ 。
(2)L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为_____ 形;C与O之间形成σ键的数目为_____ 个。
(3)X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入_____ 。(假设X晶胞形状不变)。
(4)X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。______ 。
②X晶体中Zn2+的配位数为______ 。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为_____ nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA,L2-与[Zn4O]6+的相对分子质量分别为M1和M2,则X的晶体密度为_____ g•cm-3(列出化简的计算式)。

(2)L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为
(3)X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入
| A.-Cl | B.-OH | C.-NH2 | D.-CH3 |

②X晶体中Zn2+的配位数为
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA,L2-与[Zn4O]6+的相对分子质量分别为M1和M2,则X的晶体密度为
您最近一年使用:0次
名校
解题方法
8 . 材料是人类文明进步的阶梯,第IIIA、IVA、VA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)根据价层电子对互斥理论, 、
、 、
、 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是_______ ,已知 与
与 互为等电子体,推算HCN分子中σ键与π键的数目比为
互为等电子体,推算HCN分子中σ键与π键的数目比为_______ 。
(2)M与Ga位于同周期, 的一种配合物组成为
的一种配合物组成为 。
。
①下列有关 、
、 的说法正确的是
的说法正确的是_______ (填字母)。
a.分子空间构型相同 b.中心原子杂化类型相同 c.键角大小相同
② 配体是
配体是_______ 。
③配合物T与 组成元素相同,中心离子的配位数相同。1moT溶于水,加入足量
组成元素相同,中心离子的配位数相同。1moT溶于水,加入足量 溶液只生成2molAgCl沉淀,则T的化学式为
溶液只生成2molAgCl沉淀,则T的化学式为_______ 。
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属农面的保护层,其结构与金刚石类似,晶胞结构如图所示,磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______ 。
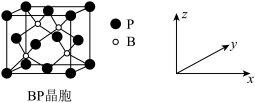
(4)已知晶胞中B与P原子最短距离为a pm,则磷化硼晶体的密度是_______  (仅列式不计算)。
(仅列式不计算)。
(1)根据价层电子对互斥理论,
 、
、 、
、 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是 与
与 互为等电子体,推算HCN分子中σ键与π键的数目比为
互为等电子体,推算HCN分子中σ键与π键的数目比为(2)M与Ga位于同周期,
 的一种配合物组成为
的一种配合物组成为 。
。①下列有关
 、
、 的说法正确的是
的说法正确的是a.分子空间构型相同 b.中心原子杂化类型相同 c.键角大小相同
②
 配体是
配体是③配合物T与
 组成元素相同,中心离子的配位数相同。1moT溶于水,加入足量
组成元素相同,中心离子的配位数相同。1moT溶于水,加入足量 溶液只生成2molAgCl沉淀,则T的化学式为
溶液只生成2molAgCl沉淀,则T的化学式为(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属农面的保护层,其结构与金刚石类似,晶胞结构如图所示,磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是

(4)已知晶胞中B与P原子最短距离为a pm,则磷化硼晶体的密度是
 (仅列式不计算)。
(仅列式不计算)。
您最近一年使用:0次
2022-12-27更新
|
197次组卷
|
2卷引用:福建省福州市福建师范大学附属中学2021-2022学年高二下学期期中考试化学试题
名校
9 . 回答下列问题:
(1)下列状态的Co微粒中,电离最外层一个电子所需能量最大的是_______(填标号)。
(2)基态Co2+的价电子轨道表示式为_______
(3)Co与Ca位于同一周期、且最外层电子数相等,但单质Co的熔点、沸点均比单质Ca高,原因是_______ 。
(4)Co配合物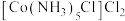 为紫红色固体,1mol
为紫红色固体,1mol 中含有的
中含有的 键数目为
键数目为_______ , 分子与
分子与 形成配合物后H—N—H键角
形成配合物后H—N—H键角_______ (填“变大”“变小”或“不变”)。
(5)Co配合物 中配位体N
中配位体N 的空间构型为
的空间构型为_______ 。
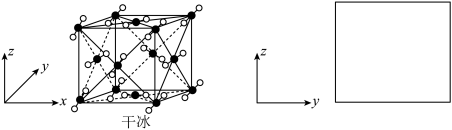
(6)NH4H2PO4中,P的_______ 轨道与O的_______ 轨道形成σ键。
(7)干冰的晶胞结构如下图所示,1个 分子周围与其距离相等且最近的
分子周围与其距离相等且最近的 分子个数为
分子个数为_______ 。若干冰晶胞沿 轴投影,试在图中画出
轴投影,试在图中画出 的投影位置(用“●”表示
的投影位置(用“●”表示 分子)
分子) _______ 。
(1)下列状态的Co微粒中,电离最外层一个电子所需能量最大的是_______(填标号)。
A.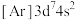 | B.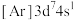 | C.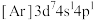 | D.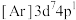 |
(3)Co与Ca位于同一周期、且最外层电子数相等,但单质Co的熔点、沸点均比单质Ca高,原因是
(4)Co配合物
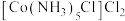 为紫红色固体,1mol
为紫红色固体,1mol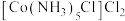 中含有的
中含有的 键数目为
键数目为 分子与
分子与 形成配合物后H—N—H键角
形成配合物后H—N—H键角(5)Co配合物
 中配位体N
中配位体N 的空间构型为
的空间构型为(6)NH4H2PO4中,P的
(7)干冰的晶胞结构如下图所示,1个
 分子周围与其距离相等且最近的
分子周围与其距离相等且最近的 分子个数为
分子个数为 轴投影,试在图中画出
轴投影,试在图中画出 的投影位置(用“●”表示
的投影位置(用“●”表示 分子)
分子) 
您最近一年使用:0次
2022-11-05更新
|
201次组卷
|
2卷引用:福建省安溪一中、养正中学、惠安一中、实验中学2022-2023学年高三上学期期中联考化学试题
名校
解题方法
10 . 在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、高碘酸等。
(1)结合事实判断CO和N2相对活泼的是___________ ,试用下表中的键能数据解释其相对活泼的原因:___________ 。
(2)元素铜与镍的第二电离能分别为ICu=1958kJ·mol–1、INi=1753kJ·mol-1,ICu>INi的原因是___________ 。
(3)已知高碘酸有两种形式,化学式分别为H5IO6(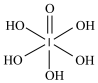 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___________ (填“>”“<”或“=”)HIO4。其原因___________
(4))KNO3中NO 的空间构型为
的空间构型为___________ ,写出与NO 互为等电子体的另一种阴离子的化学式:
互为等电子体的另一种阴离子的化学式:___________ 。
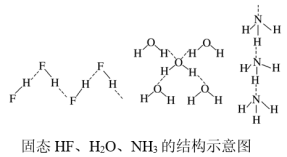
(5)已知固态HF、H2O、NH3的氢键结构和键能如下,请解释H2O、HF、NH3沸点依次降低的原因___________ 。
(6)富勒烯(C60)的结构如图所示,该物质能与氯气反应形成C60Cl10分子,1molC60Cl10分子中含有碳碳单键的数目为___________ 。

(1)结合事实判断CO和N2相对活泼的是
| CO | C-O | C=O | C≡O |
| 键能(kJ·mol-1) | 357.7 | 798.9 | 1071.9 |
| N2 | N—N | N=N | N≡N |
| 键能(kJ·mol-1) | 154.8 | 418.4 | 941.7 |
(3)已知高碘酸有两种形式,化学式分别为H5IO6(
 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6(4))KNO3中NO
 的空间构型为
的空间构型为 互为等电子体的另一种阴离子的化学式:
互为等电子体的另一种阴离子的化学式:(5)已知固态HF、H2O、NH3的氢键结构和键能如下,请解释H2O、HF、NH3沸点依次降低的原因

| 物质 | 氢键X—H…Y | 键能/kJ·mol-1 |
| (HF)n | F—H…F | 28.1 |
| 冰 | O—H…O | 18.8 |
| (NH3)n | N—H…N | 5.4 |

您最近一年使用:0次



