名校
解题方法
1 . 下表中各粒子对应的空间结构及解释均正确的是
| 选项 | 粒子 | 空间结构 | 解释 |
| A | 氨基负离子( ) ) | 直线形 | N原子采取 杂化 杂化 |
| B | 二氧化硫( ) ) | V形 | S原子采取 杂化 杂化 |
| C | 碳酸根离子( ) ) | 三角锥形 | C原子采取 杂化 杂化 |
| D | 乙炔( ) ) | 直线形 | C原子采取 杂化且C原子的价电子均参与成键 杂化且C原子的价电子均参与成键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-07更新
|
329次组卷
|
27卷引用:河南省名校联盟2020-2021学年高二下学期开学考试化学试题
河南省名校联盟2020-2021学年高二下学期开学考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 B素养拓展区(已下线)2.2 分子的空间结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)山东省泰安市宁阳一中2020-2021学年高二下学期3月月考化学试题(已下线)作业04 分子的空间结构-2021年高二化学暑假作业(人教版2019)福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题2015-2016学年江苏省泰州中学高二下期中化学试卷四川省新津中学2019-2020学年高二下学期4月月考(入学)化学试题四川省成都外国语学校2019-2020学年高二下学期期中考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题四川绵阳南山中学双语学校2020-2021学年高二上学期10月月考化学试题湖南师范大学附属中学2020-2021学年高二上学期第三次大练习化学试题(已下线)2.2.2 杂化轨道理论(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第2.2.2讲 杂化轨道理论-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)(已下线)第2章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)专题4 分子空间结构与物质性质 专题强化练5 分子(离子)的空间结构与杂化轨道类型的判断第二节 分子的空间结构 第2课时 杂化轨道理论湖南省邵阳市新邵县2021-2022学年高二上学期期末考试化学试题天津市耀华中学2022-2023学年高二上学期期末考试化学试题陕西省武功县普集高级中学2022-2023学年高二下学期第一次月考化学试题广东省阳山县南阳中学2022-2023学年高二下学期第一次月考化学试题广东省深圳龙岗四校2022--2023学年高二下学期期中考试化学试题安徽省颍上第一中学2022-2023学年高二下学期5月月考化学试题黑龙江省大庆市肇州县第二中学2023-2024学年高二上学期12月月考化学试题四川省内江市威远县威远中学校2023-2024学年高二下学期第一次月考化学试卷四川省绵阳市东辰学校2023-2024学年高二上学期第四次月考化学试题
名校
2 . 下列有关HNO2和HNO3的说法不 正确的是
| A.HNO2既有氧化性又有还原性 |
| B.HNO3不稳定,受热易分解 |
C. 的空间构型为V形 的空间构型为V形 |
D. 中N原子的杂化方式为sp3 中N原子的杂化方式为sp3 |
您最近一年使用:0次
2022-01-10更新
|
98次组卷
|
2卷引用:江苏省扬州市江都区大桥高级中学2021-2022学年高三上学期开学检测(二)化学试题
解题方法
3 . 卤素在现代生产生活中作用日益显著。回答下列问题:
(1)基态Cl原子核外电子的空间运动状态有___________ 种。
(2) 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ ;已知 熔沸点低于
熔沸点低于 ,原因为
,原因为___________ 。
(3) 可发生水解反应,机理如下:
可发生水解反应,机理如下:

已知中间体 的中心原子
的中心原子 采取的杂化类型为
采取的杂化类型为 ,则该
,则该 原子的价层电子对数为
原子的价层电子对数为___________ ,下列关于该 原子
原子 模型的空间结构推断合理的是
模型的空间结构推断合理的是___________ (填标号)。
a. 正四面体 b. 三角双锥 c. 正八面体
试解释 不易水解的原因
不易水解的原因___________ 。
(4) 晶胞属于四方晶系(边长
晶胞属于四方晶系(边长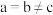 ,夹角
,夹角 ),其结构如图所示(顶角上分子轴线与
),其结构如图所示(顶角上分子轴线与 轴差
轴差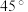 ,中心分子与顶角分子取向垂直)。该晶胞中有
,中心分子与顶角分子取向垂直)。该晶胞中有___________ 个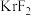 ,
, 、
、 间距离为
间距离为___________  (用含
(用含 的代数式表示,不必化简)。
的代数式表示,不必化简)。

(1)基态Cl原子核外电子的空间运动状态有
(2)
 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为 熔沸点低于
熔沸点低于 ,原因为
,原因为(3)
 可发生水解反应,机理如下:
可发生水解反应,机理如下:
已知中间体
 的中心原子
的中心原子 采取的杂化类型为
采取的杂化类型为 ,则该
,则该 原子的价层电子对数为
原子的价层电子对数为 原子
原子 模型的空间结构推断合理的是
模型的空间结构推断合理的是a. 正四面体 b. 三角双锥 c. 正八面体
试解释
 不易水解的原因
不易水解的原因(4)
 晶胞属于四方晶系(边长
晶胞属于四方晶系(边长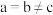 ,夹角
,夹角 ),其结构如图所示(顶角上分子轴线与
),其结构如图所示(顶角上分子轴线与 轴差
轴差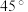 ,中心分子与顶角分子取向垂直)。该晶胞中有
,中心分子与顶角分子取向垂直)。该晶胞中有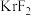 ,
, 、
、 间距离为
间距离为 (用含
(用含 的代数式表示,不必化简)。
的代数式表示,不必化简)。
您最近一年使用:0次
解题方法
4 . 下列有关物质结构与性质的因果关系论述中,错误的是
A.因为键能 ,所以 ,所以 的热稳定性强于 的热稳定性强于 |
B.因为 的孤电子对数多于 的孤电子对数多于 ,所以 ,所以 的键角小于 的键角小于 |
C.因为 的非羟基氧数目多于 的非羟基氧数目多于 ,所以 ,所以 酸性强于 酸性强于 |
D.因为 半径大于 半径大于 ,所以 ,所以 中阳离子的配位数比 中阳离子的配位数比 中的大 中的大 |
您最近一年使用:0次
5 . 1935年,在中国化学家侯德榜的领导下,中国建成了第一座生产合成氨、硝酸等的联合企业——永利制碱厂。该企业首先合成氨,氨再经铂铑催化剂催化氧化得到NO,将NO、水和空气通入吸收塔中得到硝酸。氨催化氧化法制取NO的反应为:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ∆H=-905.8kJ/mol。下列关于工业上由氨气制取浓硝酸的过程说法正确的是
4NO(g)+6H2O(g) ∆H=-905.8kJ/mol。下列关于工业上由氨气制取浓硝酸的过程说法正确的是
 4NO(g)+6H2O(g) ∆H=-905.8kJ/mol。下列关于工业上由氨气制取浓硝酸的过程说法正确的是
4NO(g)+6H2O(g) ∆H=-905.8kJ/mol。下列关于工业上由氨气制取浓硝酸的过程说法正确的是| A.NH3的空间构型为平面三角形 |
| B.催化氧化法制取NO过程中,升高温度,可以增大该反应的平衡常数 |
| C.反应中每消耗22.4L(标准状况) NH3可放出热量226.45kJ |
| D.4mol NH3 (g)和5mol O2(g)所含能量总和比4mol NO(g)和6mol H2O(g)的总能量小 |
您最近一年使用:0次
名校
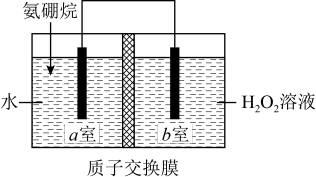
6 . 科学家利用氨硼烷设计成原电池装置如图所示,该电池在常温下即可工作,总反应为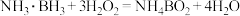 。下列说法正确的是
。下列说法正确的是
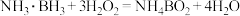 。下列说法正确的是
。下列说法正确的是
| A.NH3与BH3的分子空间构型相同 |
B.a室发生的电极反应式为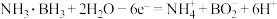 |
| C.NH3·BH3中配位原子是B |
| D.1mol NH4BO2中含7mol σ键 |
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题:
(1)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH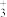 ) B.碳负离子(CH
) B.碳负离子(CH ) C. 甲基 (—CH3) D.碳烯 (
) C. 甲基 (—CH3) D.碳烯 ( CH2)
CH2)
①四种微粒中,键角为120°的是___________ (填序号)。
②碳负离子(CH )的空间构型为
)的空间构型为___________ ,与(CH )互为等电子体的一种分子是
)互为等电子体的一种分子是___________ (填化学式)。
(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为___________ 。
②在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子轨道的杂化类型为___________ ;1 mol尿素分子中,σ 键的数目为___________ 。
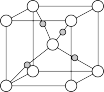
③Cu与O形成的某种化合物的晶胞结构如下图所示,若阿伏加德罗常数的值为NA,晶胞的边长为a pm,则该晶体的密度为___________ g·cm-3。
(1)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH
 ) B.碳负离子(CH
) B.碳负离子(CH ) C. 甲基 (—CH3) D.碳烯 (
) C. 甲基 (—CH3) D.碳烯 ( CH2)
CH2)①四种微粒中,键角为120°的是
②碳负离子(CH
 )的空间构型为
)的空间构型为 )互为等电子体的一种分子是
)互为等电子体的一种分子是(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为
②在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子轨道的杂化类型为
③Cu与O形成的某种化合物的晶胞结构如下图所示,若阿伏加德罗常数的值为NA,晶胞的边长为a pm,则该晶体的密度为

您最近一年使用:0次
名校
解题方法
8 . 下列说法不正确 的是
A. 比 比 的沸点高,是由于 的沸点高,是由于 分子间存在氢键 分子间存在氢键 |
B. 的VSEPR模型与其离子空间构型是一致的 的VSEPR模型与其离子空间构型是一致的 |
C.价层电子对互斥模型中, 键电子对数不计入中心原子的价层电子对数 键电子对数不计入中心原子的价层电子对数 |
D. 的VSEPR模型是正四面体形,因此 的VSEPR模型是正四面体形,因此 分子是非极性分子 分子是非极性分子 |
您最近一年使用:0次
2021-07-12更新
|
286次组卷
|
3卷引用:北京市中国农业大学附属中学2021-2022学年高三上学期开学考试化学试题
名校
解题方法
9 . 五种元素A、B、C、D、E,其中A元素形成的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍;D在B的下一周期,在同周期元素中,D形成的简单离子半径最小;E是形成化合物种类最多的元素。
(1)A、E形成的化合物E2A4分子中σ键和π键数目之比为_______ ,B、C、E三种元素的第一电离能由大到小的顺序为_______ 。
(2)与PH3相比,BA3易液化的主要原因是_______ 。
(3)BC 离子的立体构型为
离子的立体构型为_______ ,BC 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为_______ 。
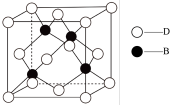
(4)化合物DB是人工合成的半导体材料,它的晶胞结构如图所示,其中最近两个D原子的核间距为a cm。该晶体的密度为_______ g·cm-3 (NA表示阿伏加德罗常数的值)。
(1)A、E形成的化合物E2A4分子中σ键和π键数目之比为
(2)与PH3相比,BA3易液化的主要原因是
(3)BC
 离子的立体构型为
离子的立体构型为 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为(4)化合物DB是人工合成的半导体材料,它的晶胞结构如图所示,其中最近两个D原子的核间距为a cm。该晶体的密度为

您最近一年使用:0次
解题方法
10 . Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)基态Cu原子的外围电子排布式为__ ,其最高能级的电子云为__ 形。
(2)SO 的空间构型为
的空间构型为___ (用文字描述);Cu2+与OH-反应能生成[Cu(OH)4]2-,Cu2+与之间OH-的化学键类型为___ ,[Cu(OH)4]2-中配位数为__ 。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为__ ,手性碳原子的数量为___ 个,由其结构推测,抗坏血酸__ 溶于水(填“难”或“易”),请解释原因__ 。

(4)Cu2O的晶胞如图2所示,则Cu原子的配位数为__ 。若NA为阿伏加德罗常数,晶体密度为ρg•cm-3,求Cu2O的晶胞边长a=__ cm。
(1)基态Cu原子的外围电子排布式为
(2)SO
 的空间构型为
的空间构型为(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为

(4)Cu2O的晶胞如图2所示,则Cu原子的配位数为
您最近一年使用:0次



