真题
解题方法
1 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: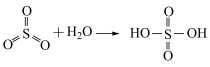
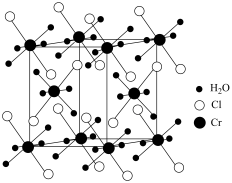
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: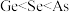 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
解题方法
2 . 连二硫酸锰(MnS2O6,其中Mn为+2价)是一种常用的果蔬保鲜剂,易溶于水,室温下其水溶液在pH为2.8~3.5时最稳定。回答下列问题:
【探究】制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。

(1)装置A中装有70%H2SO4的仪器名称为___________ ,装置B的作用是___________ 。
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是___________ ,实验时需要向C中通入稍过量的SO2,目的是___________ 。
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为___________ ,判断反应完成的现象是___________ 。
(4)连二硫酸结构式为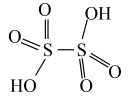 ,推断连二硫酸中S原子上
,推断连二硫酸中S原子上_________ 孤电子对(填“有”或“无”),已知甲磺酸的结构简式为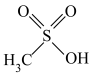 ,连二硫酸H-O的极性
,连二硫酸H-O的极性________ 甲磺酸H-O的极性(填“大于”“小于”或“等于”)。
【探究】制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。

(1)装置A中装有70%H2SO4的仪器名称为
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为
(4)连二硫酸结构式为
 ,推断连二硫酸中S原子上
,推断连二硫酸中S原子上 ,连二硫酸H-O的极性
,连二硫酸H-O的极性
您最近一年使用:0次
解题方法
3 . 磷酸铁锂电池是以磷酸铁锂(LiFePO4)为正极材料的锂离子电池,具有循环寿命长、安全性能好、无环境污染等特点。
(1)磷酸铁锂具有橄榄石结构,空间骨架结构不易发生形变,化学性质稳定。
①基态 的价层电子排布式为
的价层电子排布式为_______ 。
②Li、P、O三种元素的电负性由大到小的顺序是_______ 。
(2)硫酸亚铁(FeSO4)可用于制备磷酸铁锂。
①根据价层电子对互斥理论可知, 的空间结构为
的空间结构为_______ 。
②比较S原子和O原子的第一电离能大小,并从原子结构的角度说明理由:_______ 。
(3)草酸亚铁(FeC2O4)也可用于制备磷酸铁锂。草酸根离子的结构简式为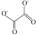 ,其中碳原子的杂化轨道类型为
,其中碳原子的杂化轨道类型为_______ 。
(4)磷酸铁(FePO4)与磷酸铁锂结构相似,其中 围绕
围绕 和
和 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,
分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,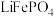 中的
中的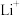 会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
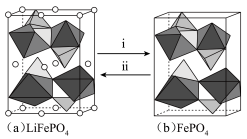
①i表示_______ (填“充电”或“放电”)过程。
②已知Li+的脱嵌率= 。某时刻,若正极材料中Li+的脱嵌率为
。某时刻,若正极材料中Li+的脱嵌率为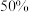 ,则其中
,则其中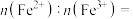
_______ 。
(1)磷酸铁锂具有橄榄石结构,空间骨架结构不易发生形变,化学性质稳定。
①基态
 的价层电子排布式为
的价层电子排布式为②Li、P、O三种元素的电负性由大到小的顺序是
(2)硫酸亚铁(FeSO4)可用于制备磷酸铁锂。
①根据价层电子对互斥理论可知,
 的空间结构为
的空间结构为②比较S原子和O原子的第一电离能大小,并从原子结构的角度说明理由:
(3)草酸亚铁(FeC2O4)也可用于制备磷酸铁锂。草酸根离子的结构简式为
 ,其中碳原子的杂化轨道类型为
,其中碳原子的杂化轨道类型为(4)磷酸铁(FePO4)与磷酸铁锂结构相似,其中
 围绕
围绕 和
和 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,
分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,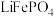 中的
中的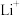 会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
①i表示
②已知Li+的脱嵌率=
 。某时刻,若正极材料中Li+的脱嵌率为
。某时刻,若正极材料中Li+的脱嵌率为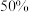 ,则其中
,则其中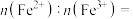
您最近一年使用:0次
名校
解题方法
4 . 2022年9月9日,国家航天局、国家原子能机构联合在北京发布嫦娥五号最新科学成果,中核集团核工业北京地质研究院科研团队首次在月球上发现的新矿物,被命名为“嫦娥石”,我国成为世界上第三个在月球发现新矿物的国家。
回答下列问题:
(1)中核集团核工业北京地质研究院科研团队,通过晶体___________ 实验等一系列高新技术手段,成功解译其晶体结构。
(2)嫦娥石是一种陨磷钠镁钙石类矿物,基态P、Na、Mg、Ca四种元素的原子第一电离能由大到小的顺序为___________ 。
(3)从晶体结构上看,嫦娥石可以分为两大部分,其中阴离子结构单元为[Fe(PO4)6]16-,请写出Fe2+的基态价层电子排布式___________ ,PO 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
(4)从结构角度分析Fe3+比Fe2+稳定的原因___________ 。
(5)嫦娥石的一种伴生矿物为方石英,方石英结构和金刚石相似,其晶胞结构如图所示,Si-O键长为anm,∠AED=109°28′,已知阿伏伽德罗常数为NA,则方石英晶体的的密度为___________ g·cm-3(列出计算式即可)。

回答下列问题:
(1)中核集团核工业北京地质研究院科研团队,通过晶体
(2)嫦娥石是一种陨磷钠镁钙石类矿物,基态P、Na、Mg、Ca四种元素的原子第一电离能由大到小的顺序为
(3)从晶体结构上看,嫦娥石可以分为两大部分,其中阴离子结构单元为[Fe(PO4)6]16-,请写出Fe2+的基态价层电子排布式
 的VSEPR模型名称为
的VSEPR模型名称为(4)从结构角度分析Fe3+比Fe2+稳定的原因
(5)嫦娥石的一种伴生矿物为方石英,方石英结构和金刚石相似,其晶胞结构如图所示,Si-O键长为anm,∠AED=109°28′,已知阿伏伽德罗常数为NA,则方石英晶体的的密度为

您最近一年使用:0次
2023-08-12更新
|
414次组卷
|
2卷引用:浙江省金丽衢十二校2022-2023学年高三上学期第一次联考化学试题
名校
5 . 硫化硅分子式为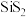 ,遇水会发生水解。下列推测
,遇水会发生水解。下列推测不合理 的是
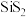 ,遇水会发生水解。下列推测
,遇水会发生水解。下列推测A.与硫化钠作用可生成 |
B.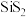 在空气中可以被点燃 在空气中可以被点燃 |
C.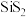 的空间结构名称为V形 的空间结构名称为V形 |
D.水解产物可能为 和 和 |
您最近一年使用:0次
2023-04-21更新
|
380次组卷
|
4卷引用:浙江省9+1联盟2022-2023学年高二下学期期中考试化学试题
浙江省9+1联盟2022-2023学年高二下学期期中考试化学试题(已下线)【2023】【高二下】【期中考】【9+1联盟】【高中化学】【洪翔峰收集】河南省南阳市第一中学校2022-2023学年高二下学期5月月考化学试题(已下线)实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
22-23高二上·浙江杭州·期中
名校
解题方法
6 . 下列有关描述正确的是
| A.O3为非极性分子 |
| B.NCl3的空间结构为平面三角形 |
C. 的VSEPR模型、空间结构均为平面三角形 的VSEPR模型、空间结构均为平面三角形 |
D. 的VSEPR模型、空间结构相同 的VSEPR模型、空间结构相同 |
您最近一年使用:0次
名校
解题方法
7 . AlN具有耐高温、抗冲击等优良品质,广泛应用于电子工业、陶瓷工业,其晶胞结构如下图所示。下列说法错误的是


A.基态Al原子的价电子排布式为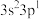 | B.Al原子位于N原子形成的四面体空隙 |
| C.AlN晶体中含有配位键 | D.AlN晶体属于离子晶体 |
您最近一年使用:0次
2022-11-30更新
|
571次组卷
|
2卷引用:浙江省台州市路桥中学2022-2023学年高二下学期期中考试化学试题
8 . 以钒化合物作催化剂制备高纯度次氯酸的机理如图,已知钒元素V最高化合价为+5价,N(His404)、 N(His496)为氨基酸,下列说法不正确 的是
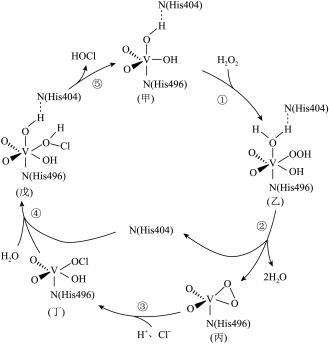

| A.反应①④中,都形成配位键,都有氢氧键的断裂和形成 |
| B.反应过程中,钒化合物甲是催化剂,乙、丙、丁、戊是中间产物 |
| C.在该催化循环过程中,中心原子V的化合价和VSEPR模型发生了改变 |
| D.此图钒化合物的每一次循环使无机物发生的净反应:H2O2+Cl-+H+=HOCl+H2O |
您最近一年使用:0次
9 .  是一种重要的工业原料,常用作媒染剂等。已知
是一种重要的工业原料,常用作媒染剂等。已知 常温下是无色液体,在潮湿空气中易水解,熔点
常温下是无色液体,在潮湿空气中易水解,熔点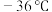 ,沸点
,沸点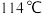 。工业上制备
。工业上制备 的工艺流程如图:
的工艺流程如图:
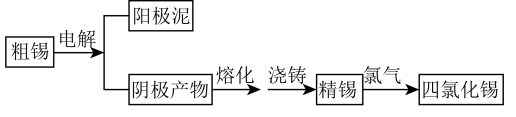
请回答下列问题;
(1)粗锡电解精炼时,常用硅氟酸 和硅氟酸亚锡
和硅氟酸亚锡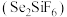 为电解液。已知
为电解液。已知 为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为
为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为___________ 。阴极的电极反应式为___________ ,根据价层电子对互斥理论和杂化轨道理论,判断 离子的空间构型是
离子的空间构型是___________ ,硅的杂化类型是___________ 。
(2)某同学模拟工业制法设计了由 与
与 反应制取
反应制取 的实验装置:
的实验装置:
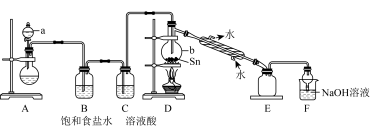
①a中浓盐酸与烧瓶内固体反应生成 ,则烧瓶内固体可以选用
,则烧瓶内固体可以选用___________ ,仪器b的名称为___________ 。
②装置D的主要缺点是___________ ,除此之外,整套装置还有的缺点是___________ 。
③制取 中可能会产生少量
中可能会产生少量 ,为测定产品中
,为测定产品中 的含量,可选用重铬酸钾标准液滴定,准确称取该样品
的含量,可选用重铬酸钾标准液滴定,准确称取该样品 放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成
放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成 溶液,取
溶液,取 于锥形瓶中,用
于锥形瓶中,用 重铬酸钾标准溶液滴定至终点,消耗标准液
重铬酸钾标准溶液滴定至终点,消耗标准液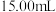 ,则产品中
,则产品中 的含量为
的含量为___________  (用含m的代数式表示),测定
(用含m的代数式表示),测定 含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是___________ (用离子方程式表示)。
 是一种重要的工业原料,常用作媒染剂等。已知
是一种重要的工业原料,常用作媒染剂等。已知 常温下是无色液体,在潮湿空气中易水解,熔点
常温下是无色液体,在潮湿空气中易水解,熔点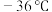 ,沸点
,沸点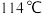 。工业上制备
。工业上制备 的工艺流程如图:
的工艺流程如图:
请回答下列问题;
(1)粗锡电解精炼时,常用硅氟酸
 和硅氟酸亚锡
和硅氟酸亚锡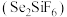 为电解液。已知
为电解液。已知 为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为
为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为 离子的空间构型是
离子的空间构型是(2)某同学模拟工业制法设计了由
 与
与 反应制取
反应制取 的实验装置:
的实验装置:
①a中浓盐酸与烧瓶内固体反应生成
 ,则烧瓶内固体可以选用
,则烧瓶内固体可以选用②装置D的主要缺点是
③制取
 中可能会产生少量
中可能会产生少量 ,为测定产品中
,为测定产品中 的含量,可选用重铬酸钾标准液滴定,准确称取该样品
的含量,可选用重铬酸钾标准液滴定,准确称取该样品 放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成
放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成 溶液,取
溶液,取 于锥形瓶中,用
于锥形瓶中,用 重铬酸钾标准溶液滴定至终点,消耗标准液
重铬酸钾标准溶液滴定至终点,消耗标准液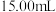 ,则产品中
,则产品中 的含量为
的含量为 (用含m的代数式表示),测定
(用含m的代数式表示),测定 含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
您最近一年使用:0次
名校
解题方法
10 . 下列说法错误的是
| A.基态B原子核外电子的运动状态有5种 |
| B.二氯乙酸的酸性强于氯乙酸 |
C. 的价电子对分布的几何构型与分子的空间结构不一致 的价电子对分布的几何构型与分子的空间结构不一致 |
| D.可以通过红外光谱仪来测定分子的相对分子质量 |
您最近一年使用:0次
2022-08-22更新
|
1269次组卷
|
4卷引用:化学预测卷(五)-预测卷(浙江专版)



