名校
1 . 下列有关共价键和键参数的说法不正确的是
| A.一个丙烯(C3H6)分子中含有8个σ 键和1个π 键 |
| B.碳碳双键比碳碳单键键能更大,故碳碳双键更稳定 |
| C.C-H键比Si-H键键长更短,故CH4比SiH4更稳定 |
| D.由于孤电子对的存在,H2O分子的键角小于109°28′ |
您最近一年使用:0次
名校
2 . 根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的是( )
| A.PCl3 | B.HCHO |
| C.H3O+ | D.PH3 |
您最近一年使用:0次
2018-08-01更新
|
432次组卷
|
13卷引用:贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题
贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题云南省盐津县第一中学2018-2019学年高二上学期12月份考试化学试题【全国百强校】新疆乌鲁木齐市23中学2018-2019学年高二3月月考化学试题山西省朔州市怀仁县大地学校2019-2020学年高二下学期第二次月考化学试题广东省清远市阳山县南阳中学2023-2024学年高二下学期第一次月考化学试题(已下线)2012-2013学年云南省芒市中学高二上学期期中考试化学试卷【全国百强校】陕西省西安中学2017-2018学年高二(实验班)下学期期末考试化学试题(已下线)2019年3月7日 《每日一题》人教选修3-价层电子对互斥理论的应用贵州省思南中学2019-2020学年高二下学期期中考试化学试题高二选择性必修2(人教版2019)第二章 分结构与性质 第二节 分子的空间结构 课时1 分子的空间结构 价层电子对互斥模型吉林省通化县综合高级中学2020-2021学年高二下学期期中考试化学试题黑龙江省大庆市高中2020-2021学年高二下学期期末考试化学试题2.2.1 分子结构的测定和多样性 价层电子对互斥模型-课堂例题
名校
解题方法
3 . 关于CH4、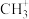 、
、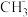 三种粒子的说法,正确的是
三种粒子的说法,正确的是
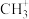 、
、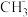 三种粒子的说法,正确的是
三种粒子的说法,正确的是 | A.C原子的杂化类型都相同 |
B.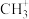 是三角锥形 是三角锥形 |
C.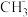 与BCl3构型相同 与BCl3构型相同 |
D.CH4与 互为等电子体 互为等电子体 |
您最近一年使用:0次
2018-07-30更新
|
980次组卷
|
2卷引用:福建省莆田第六中学2017-2018学年高二6月月考化学试题A
名校
4 . 氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的VSEPR模型、分子的几何构型和中心原子(S)采取杂化方式的说法正确的是
| A.四面体形、三角锥形、sp3 | B.平面三角形、V形、sp2 |
| C.平面三角形、平面三角形、sp2 | D.四面体形、三角锥形、sp2 |
您最近一年使用:0次
2018-06-30更新
|
1747次组卷
|
7卷引用:宁夏银川市银川二中2019-2020学年高二上学期第一次月考化学试题
名校
5 . 已知N2O与CO2互为等电子体.下列关于N2O的说法正确的是( )
| A.N2O的空间构型与CO2构型不同 |
| B.N2O的空间构型与H2O构型相似 |
| C.N2O的空间构型与NH3构型相似 |
| D.N2O的空间构型为直线形 |
您最近一年使用:0次
2018-06-25更新
|
193次组卷
|
5卷引用:云南省石屏县一中2017-2018学年高二下学期六月份月考化学试题
名校
6 . 下列离子的 VSEPR 模型与离子的空间立体构型一致的是
| A.ClO3- | B.NO2- | C.ClO4- | D.SO32- |
您最近一年使用:0次
2018-06-01更新
|
2170次组卷
|
2卷引用:【全国百强校】广东省佛山市第一中学2018-2019学年高二下学期第一次月考化学试题
名校
解题方法
7 . 锰、砷、镓及其相关化合物用途非常广泛。
(1)Mn2+基态核外电子排布式为__________ 。
(2)砷与镓、硒是同周期的主族元素,其第一电离能从小到大的顺序是__________ 。
(3)BrCH2CN可用于制备砷叶立德,BrCH2CN 分子中碳原子杂化轨道类型是__________ 。
(4)在AlCl3存在下,将C2H2通入AsCl3可得到(ClCH=CH)2AsCl等物质,AsCl3分子的几何构型为__________ ,1mol(ClCH=CH)2AsCl分子中含σ键的数目为__________ 。
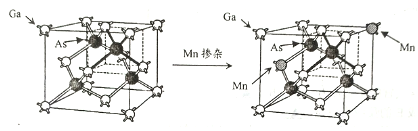
(5)GaAs是一种重要的半导体材料,按图示掺杂锰后可得稀磁性半导体材料(晶体结构不变),则该材料晶体中n(Ga) ∶n(Mn) ∶n(As)=__________ 。
(1)Mn2+基态核外电子排布式为
(2)砷与镓、硒是同周期的主族元素,其第一电离能从小到大的顺序是
(3)BrCH2CN可用于制备砷叶立德,BrCH2CN 分子中碳原子杂化轨道类型是
(4)在AlCl3存在下,将C2H2通入AsCl3可得到(ClCH=CH)2AsCl等物质,AsCl3分子的几何构型为
(5)GaAs是一种重要的半导体材料,按图示掺杂锰后可得稀磁性半导体材料(晶体结构不变),则该材料晶体中n(Ga) ∶n(Mn) ∶n(As)=

您最近一年使用:0次
2018-05-17更新
|
301次组卷
|
2卷引用:江苏省扬州中学2021届高三10月月考化学试题
名校
8 . 预测H2S和BF3的立体结构,两个结论都正确的是
| A.V形;平面三角形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.直线形;三角锥形 |
您最近一年使用:0次
2018-05-02更新
|
156次组卷
|
3卷引用:黑龙江省大庆十中2018-2019学年高二下学期第二次月考化学试题
名校
9 . 在HF、H2O、NH3、CS2、CH4、N2、BF3分子中:
(1)以非极性键结合的非极性分子是________ ;
(2)以极性键结合的具有直线形结构的非极性分子是________ ;
(3)以极性键结合的具有正四面体形结构的非极性分子是________ ;
(4)以极性键结合的具有三角锥形结构的极性分子是________ ;
(5)以极性键结合的具有sp3杂化轨道结构的分子是________ ;
(6)以极性键结合的具有sp2杂化轨道结构的分子是________ 。
(1)以非极性键结合的非极性分子是
(2)以极性键结合的具有直线形结构的非极性分子是
(3)以极性键结合的具有正四面体形结构的非极性分子是
(4)以极性键结合的具有三角锥形结构的极性分子是
(5)以极性键结合的具有sp3杂化轨道结构的分子是
(6)以极性键结合的具有sp2杂化轨道结构的分子是
您最近一年使用:0次
2018-04-24更新
|
513次组卷
|
6卷引用:宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题
宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题四川省南充高级中学2020-2021学年高二上学期第二次月考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 学科素养提升鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2章学科素养提升(已下线)2.3.1 共价键的极性 范德华力-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)第二章 分子结构与性质(A卷)
名校
10 . 用价层电子对互斥理论预测H2S和CH2O分子的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
您最近一年使用:0次



