解题方法
1 . 一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为__________ 。
②NO3-的空间构型是____________________________________________ (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为________ 。
②1 mol CO2中含有的σ键数目为____________ 。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______________ 。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为
②NO3-的空间构型是
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为
②1 mol CO2中含有的σ键数目为
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
您最近一年使用:0次
名校
解题方法
2 . 根据价层电子对互斥理论,判断下列分子或者离子的空间构型是平面三角形的是( )
| A.CO2 | B.H3O+ | C.BF3 | D.PO43﹣ |
您最近一年使用:0次
2020-01-07更新
|
88次组卷
|
2卷引用:云南省临沧市双江县第一中学2019-2020学年高二上学期12月月考化学试题
12-13高二上·四川自贡·阶段练习
名校
3 . 根据价层电子对互斥理论及原子的杂化理论判断BF3分子的空间构型和中心原子的杂化方式为( )
| A.直线形 sp杂化 | B.三角形 sp2杂化 |
| C.三角锥形 sp2杂化 | D.三角锥形 sp3杂化 |
您最近一年使用:0次
2020-01-06更新
|
283次组卷
|
20卷引用:2014届四川省富顺一中高二上学期第一次月考化学试卷
(已下线)2014届四川省富顺一中高二上学期第一次月考化学试卷2016-2017学年四川省阆中中学高二上教学质检化学试卷贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题云南省元江哈尼族彝族傣族自治县一中2018-2019学年高二上学期12月考试化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题河南省林州市第一中学2019-2020学年高二4月月考(实验班)化学试题四川省越西中学2019-2020学年高二5月月考化学试题(已下线)2012-2013学年江苏省郑梁梅中学高二下学期期末考试化学试卷宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第2章 分子结构与性质综合练习3宁夏吴忠市高二人教版选修3第2章 分子结构与性质综合练习2宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第2章 分子结构与性质综合练习1河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.2 第2课时人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第2课时)云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题云南省西双版纳州民族中学2017-2018学年高二6月份考试化学试题河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题吉林省公主岭市范家屯镇第一中学2018-2019学年高二下学期期中考试化学试题云南省玉溪市江川二中2019-2020学年高二上学期期中考试化学试题云南省普洱市景东县第二中学2019-2020学年高二上学期期末考试化学试题广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题
名校
解题方法
4 . 在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为______ 。
(2)Na、O、S简单离子半径由大到小的顺序为___________ (用简单离子符号表示离子半径)。
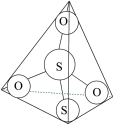
(3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为________ 。
(4)Na3[Ag(S2O3)2]中存在的作用力有_____________ 。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为____________________ ;与SO3相比,____________ 的键角更大,原因是________________________________ 。
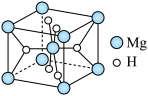
(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为____________________ ,已知该晶体的密度为ρg/cm3,则该晶胞的体积为_________ cm3(用含ρ、NA的代数式表示)。
(1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为
(2)Na、O、S简单离子半径由大到小的顺序为

(3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为
(4)Na3[Ag(S2O3)2]中存在的作用力有
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为

(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为
您最近一年使用:0次
名校
5 . 下表中各粒子、粒子对应的立体构型及解释均正确的是( )
| 选项 | 粒子 | 立体构型 | 解释 |
| A | 氨基负离子(NH2—) | 直线形 | N原子采用sp杂化 |
| B | 二氧化硫(SO2) | V形 | S原子采用sp3杂化 |
| C | 碳酸根离子(CO32—) | 三角锥形 | C原子采用sp3杂化 |
| D | 碘三正离子(I3+) | V形 | I原子采用sp3杂化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________ 。
(2)实验室用KSCN溶液、苯酚(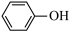 )检验Fe3+。N、O、S的第一电离能由大到小的顺序为
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______ (用元素符号表示),苯酚中碳原子的杂化轨道类型为_______ 。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________ 。FeSO4常作补铁剂,SO42-的立体构型是__________ 。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________ molσ键,与CO互为等电子体的离子是__________ (填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____ 。
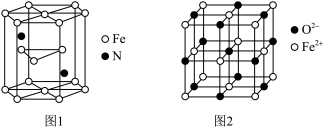
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加 德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____ ;Fe2+与O2-的最短核间距为___________ pm。
(1)基态Fe3+的电子排布式为
(2)实验室用KSCN溶液、苯酚(
 )检验Fe3+。N、O、S的第一电离能由大到小的顺序为
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加 德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为
您最近一年使用:0次
2019-12-11更新
|
707次组卷
|
9卷引用:【校级联考】甘肃省河西五地2018-2019学年高二第二学期联考化学试题
【校级联考】甘肃省河西五地2018-2019学年高二第二学期联考化学试题四川省绵阳南山中学2020届高三9月月考理科综合化学试题宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题河北省石家庄市第二中学2020届高三下学期教学质量检测模拟考试理综化学试题【市级联考】广东省揭阳市2019届高三上学期期末学业水平考试理科综合化学试题【全国百强校】河北省武邑中学2019届高三上学期期末考试化学试题【市级联考】山东省泰安市2019届高三下学期3月第一次模拟考试理科综合化学试题2020届高考化学二轮复习物质结构与性质专题练习(已下线)专题6.4 物质结构与性质(选考)(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升
名校
解题方法
7 . 【化学——选修3:物质结构与性质】
钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为________________ ,未成对电子数为________________ 。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______ ;H2O中O的杂化形式为_____ 。H2O是_____ 分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___ 。阳离子的立体构型是___________ 。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)___________ 种。
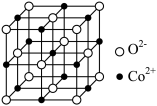
(3)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____ 个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______ (用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿伏加 德罗常数为NA)。
钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点
②[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为
(3)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有

您最近一年使用:0次
2019-12-04更新
|
356次组卷
|
3卷引用:云南省曲靖市陆良县2020届高三上学期第二次适应性考试化学试题
解题方法
8 . X、Y、Z、J、Q、W为前四周期元素,原子序数依次增大。元素Y在地壳中含量最高,W的一种常见高价氧化物是红棕色粉末,常用于油漆、涂料、油墨的红色染料,25℃X、Z、J、Q的最高价氧化物对应水化物溶液(浓度均为0.01mol·L-1)的pH与原子序数的关系如图所示。

根据上述信息进行判断,并回答下列问题:
(1)W在周期表中的位置__ 。比较X、Y、Z的简单离子半径大小为__ <____ <__ (用离子符号表示);
(2)元素的非金属性Y__ J(填“>”或“<”)。下列各项中,不能说明这一结论的有__ (填序号)。
A.J的氢化物的水溶液放置在空气中会变浑浊
B.Y与J之间形成的化合物中元素的化合价。
C.Y和J的单质的状态
D.Y和J在周期表中的位置
(3)X、J、Q这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_____ (填化学式);酸根呈三角锥结构的酸是___ (填化学式)。
(4)Y和Q形成的化合物Q2Y的立体构型为__ ,Q的单质与湿润的Na2CO3反应可制备Q2Y,其化学方程式为___ 。

根据上述信息进行判断,并回答下列问题:
(1)W在周期表中的位置
(2)元素的非金属性Y
A.J的氢化物的水溶液放置在空气中会变浑浊
B.Y与J之间形成的化合物中元素的化合价。
C.Y和J的单质的状态
D.Y和J在周期表中的位置
(3)X、J、Q这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是
(4)Y和Q形成的化合物Q2Y的立体构型为
您最近一年使用:0次
2019-11-28更新
|
306次组卷
|
2卷引用:山东省烟台市2020届高三上学期期中考试化学试题
名校
解题方法
9 . 氮和磷元素的单质和化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列问题:
(1)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为___ ,其中的阴离子的空间构型为___ 。
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有___ 个σ键。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因___ 。
(4)P4S3可用于制造火柴,其分子结构如图1所示。
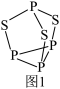
①P4S3分子中硫原子的杂化轨道类型为___ 。
②每个P4S3分子中含孤电子对的数目为___ 。
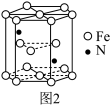
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为___ 。若晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为__ g·cm−3(用含a、c和NA的式子表示)
(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]__ ;化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是___ (填元素符号)。
几种稀土元素的电离能(单位:kJ·mol−1)
(1)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因
(4)P4S3可用于制造火柴,其分子结构如图1所示。

①P4S3分子中硫原子的杂化轨道类型为
②每个P4S3分子中含孤电子对的数目为
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为

(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]
几种稀土元素的电离能(单位:kJ·mol−1)
| 元素 | I1 | I2 | I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 7019 |
| Y(铱) | 616 | 1181 | 1980 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3547 |
您最近一年使用:0次
2019-11-22更新
|
374次组卷
|
2卷引用:四川省绵阳市绵阳中学2020届高三下学期3月考试理科综合化学试题
名校
10 . 下列分子的中心原子是 sp2 杂化的是( )
| A.CH4 | B.BF3 | C.H2O | D.NF3 |
您最近一年使用:0次
2019-11-21更新
|
208次组卷
|
3卷引用:湖南省怀化市中方县第一中学2021-2022学年高二下学期3月教学质量检测化学试题



