名校
解题方法
1 . 硅烷广泛应用在现代高科技领域。
制备硅烷的反应为 。
。
(1)①基态硅原子的价层电子轨道表示式为___________ 。
② 中,硅的化合价为+4价。硅显正化合价的原因是
中,硅的化合价为+4价。硅显正化合价的原因是___________ 。
③下列说法正确的是___________ (填字母)。
a. 的稳定性比
的稳定性比 的差
的差
b. 中4个
中4个 的键长相同,
的键长相同, 的键角为
的键角为
c. 中硅原子以4个
中硅原子以4个 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的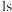 轨道重叠,形成4个
轨道重叠,形成4个 键
键
④ 的沸点(-86℃)高于
的沸点(-86℃)高于 的沸点(-112℃),原因是
的沸点(-112℃),原因是___________ 。
(2) 的晶胞结构如图所示,晶胞的体积为
的晶胞结构如图所示,晶胞的体积为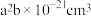 。
。 的
的 模型名称为
模型名称为___________ 。
②用 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶体密度为
晶体密度为___________  (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
制备硅烷的反应为
 。
。(1)①基态硅原子的价层电子轨道表示式为
②
 中,硅的化合价为+4价。硅显正化合价的原因是
中,硅的化合价为+4价。硅显正化合价的原因是③下列说法正确的是
a.
 的稳定性比
的稳定性比 的差
的差b.
 中4个
中4个 的键长相同,
的键长相同, 的键角为
的键角为
c.
 中硅原子以4个
中硅原子以4个 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的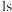 轨道重叠,形成4个
轨道重叠,形成4个 键
键④
 的沸点(-86℃)高于
的沸点(-86℃)高于 的沸点(-112℃),原因是
的沸点(-112℃),原因是(2)
 的晶胞结构如图所示,晶胞的体积为
的晶胞结构如图所示,晶胞的体积为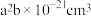 。
。
 的
的 模型名称为
模型名称为②用
 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶体密度为
晶体密度为 (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
2 . NH3具有易液化、含氢密度高、应用广泛等优点,NH3的合成及应用一直是科学研究的重要课题。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为_____ 。
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是_____ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_____ 。
②NaHCO3分解得Na2CO3., 空间结构为
空间结构为_____ 。
(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
①NH3的中心原子的杂化轨道类型为_____ 。
②比较熔点:NH3BH3_____ CH3CH3(填“>”或“<”)。
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为_____ 。
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是_____ 。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3.,
 空间结构为
空间结构为(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
| 元素 | H | B | N | F |
| 电负性 | 2.1 | 2.0 | 3.0 | 4.0 |
②比较熔点:NH3BH3
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是
您最近一年使用:0次
2024-03-03更新
|
282次组卷
|
2卷引用:北京市第十九中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
3 . 水丰富而独特的性质与其结构密切相关。
(1)对于水分子中的共价键,依据原子轨道重叠的方式判断,属于___________ 键;依据О与H的电负性判断,属于___________ 共价键。
(2)水分子中,氧原子的价层电子对数为___________ ,杂化轨道类型为___________ 。
(3)水是优良的溶剂,常温常压下 极易溶于水,从微粒间相互作用的角度分析原因,请写出两条:
极易溶于水,从微粒间相互作用的角度分析原因,请写出两条:
①___________ ;
②___________ 。
(4)酸溶于水可形成 ,
, 的电子式为
的电子式为___________ 。由于成键电子对和孤电子对之间的斥力不同,会对微粒的空间结构产生影响,如 中H-N-H的键角大于
中H-N-H的键角大于 中H-O-H的键角,据此判断
中H-O-H的键角,据此判断 和
和 的键角大小:
的键角大小:
___________  (填“>”或“<”)。
(填“>”或“<”)。
(5)我国科学家利用高分辨原子力显微镜技术,首次拍摄到质子在水层中的原子级分辨图像,发现两种结构的水合质子,其中一种结构如图所示。下列有关该水合质子的说法正确的是___________ 。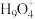
B.氢、氧原子都处于同一平面
C.氢、氧原子间均以氢键结合
(1)对于水分子中的共价键,依据原子轨道重叠的方式判断,属于
(2)水分子中,氧原子的价层电子对数为
(3)水是优良的溶剂,常温常压下
 极易溶于水,从微粒间相互作用的角度分析原因,请写出两条:
极易溶于水,从微粒间相互作用的角度分析原因,请写出两条:①
②
(4)酸溶于水可形成
 ,
, 的电子式为
的电子式为 中H-N-H的键角大于
中H-N-H的键角大于 中H-O-H的键角,据此判断
中H-O-H的键角,据此判断 和
和 的键角大小:
的键角大小:
 (填“>”或“<”)。
(填“>”或“<”)。(5)我国科学家利用高分辨原子力显微镜技术,首次拍摄到质子在水层中的原子级分辨图像,发现两种结构的水合质子,其中一种结构如图所示。下列有关该水合质子的说法正确的是

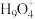
B.氢、氧原子都处于同一平面
C.氢、氧原子间均以氢键结合
您最近一年使用:0次
2024-02-13更新
|
191次组卷
|
2卷引用:北京市汇文中学2023-2024学年高二上学期期末化学试题
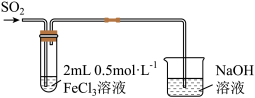
4 . 某小组探究不同阴离子与Ag+的结合倾向并分析相关转化Ag
资料:a. 和
和 均为白色,难溶于水。
均为白色,难溶于水。
b. 与
与 、
、 能生成
能生成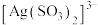 、
、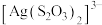
(1)探究 、
、 与
与 的结合倾向
的结合倾向
向NaCl溶液中加入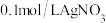 溶液,产生白色浑浊:再向其中滴入
溶液,产生白色浑浊:再向其中滴入 溶液,溶液变澄清。澄清溶液中
溶液,溶液变澄清。澄清溶液中 价银的存在形式
价银的存在形式___________ (填化学式)。
(2)探究 、
、 、
、 与
与 的结合倾向
的结合倾向
由实验I推知:与 结合倾向:
结合倾向:
___________  (填“>”或“<”)
(填“>”或“<”)
(3)探究 、
、 、
、 与
与 的结合倾向
的结合倾向
实验步骤:取两等份AgBr浊液,分别滴加等浓度等体积的 和
和 溶液。
溶液。
实验现象:___________
实验结论:与 结合倾向
结合倾向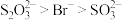 ,请补全实验现象。
,请补全实验现象。
(4)探究 与
与 的反应
的反应
写出实验Ⅳ中白色沉淀变黑色的化学方程式并分析原因___________ 。
(5)从结构角度解释上述实验的结论
① 可以看做是
可以看做是 中的一个O原子被S原子取代,则
中的一个O原子被S原子取代,则 的空间构型为
的空间构型为___________ 。资料显示S原子与 结合比O原子更稳定。试从空间结构角度解释
结合比O原子更稳定。试从空间结构角度解释 与
与 、
、 结合倾向强弱的原因
结合倾向强弱的原因___________ 。
②Cl-、Br-、I-与Ag+的结合生成沉淀的Ksp逐渐减小,试从化学键类型的角度解释在水溶液中溶解度的变化___________ (已知电负性:Cl 3.0 Br 2.8 I 2.5 Ag 1.9)。
资料:a.
 和
和 均为白色,难溶于水。
均为白色,难溶于水。b.
 与
与 、
、 能生成
能生成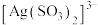 、
、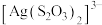
(1)探究
 、
、 与
与 的结合倾向
的结合倾向向NaCl溶液中加入
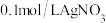 溶液,产生白色浑浊:再向其中滴入
溶液,产生白色浑浊:再向其中滴入 溶液,溶液变澄清。澄清溶液中
溶液,溶液变澄清。澄清溶液中 价银的存在形式
价银的存在形式(2)探究
 、
、 、
、 与
与 的结合倾向
的结合倾向 | 实验 | 滴管 | 试管 | 现象 |
| I | 10滴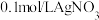 溶液 溶液 | 等浓度的NaI和 溶液 溶液 | 黄色沉淀 | |
| Ⅱ | 等浓度的NaI和 溶液 溶液 | 黄色沉淀 |
 结合倾向:
结合倾向:
 (填“>”或“<”)
(填“>”或“<”)(3)探究
 、
、 、
、 与
与 的结合倾向
的结合倾向实验步骤:取两等份AgBr浊液,分别滴加等浓度等体积的
 和
和 溶液。
溶液。实验现象:
实验结论:与
 结合倾向
结合倾向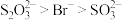 ,请补全实验现象。
,请补全实验现象。(4)探究
 与
与 的反应
的反应 | 实验 | 滴管 | 试管 | 现象 |
| Ⅲ |  溶液 溶液 |  溶液 溶液 | 白色沉淀,振荡后消失 | |
| Ⅳ | 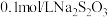 溶液 溶液 | 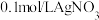 溶液 溶液 | 白色沉淀,逐渐变为灰色,最终为黑色沉淀(AgS) |
(5)从结构角度解释上述实验的结论
①
 可以看做是
可以看做是 中的一个O原子被S原子取代,则
中的一个O原子被S原子取代,则 的空间构型为
的空间构型为 结合比O原子更稳定。试从空间结构角度解释
结合比O原子更稳定。试从空间结构角度解释 与
与 、
、 结合倾向强弱的原因
结合倾向强弱的原因②Cl-、Br-、I-与Ag+的结合生成沉淀的Ksp逐渐减小,试从化学键类型的角度解释在水溶液中溶解度的变化
您最近一年使用:0次
5 . 金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
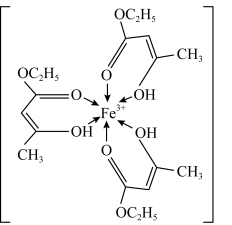
①基态铁离子的核外电子填充在___________ 个原子轨道中;
②此配离子中碳原子的杂化轨道类型为___________ ;
③此配离子中含有的化学键类型为___________ 。
A.离子键 B.金属键 C.共价键 D.配位键 E.σ键 F.π键
(2) 与钴盐形成的配离子
与钴盐形成的配离子 可用于检验
可用于检验 的存在。
的存在。 离子的VSEPR模型名称为
离子的VSEPR模型名称为___________ 。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物 和
和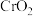 ,其中适合作录音带磁粉原料的是
,其中适合作录音带磁粉原料的是___________ 。
(4)锰的一种配合物的化学式为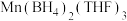 。已知:原子个数和价电子总数分别对应相等的分子、离子或基团称为等电子体。请写出两种与
。已知:原子个数和价电子总数分别对应相等的分子、离子或基团称为等电子体。请写出两种与 互为等电子体的微粒
互为等电子体的微粒___________ (请写出一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为___________ ,已知晶胞密度为ρg/cm ,用
,用 表示阿伏加德罗常数的值,则晶胞的边长为
表示阿伏加德罗常数的值,则晶胞的边长为___________ cm(列计算式)。
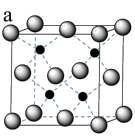
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:

①基态铁离子的核外电子填充在
②此配离子中碳原子的杂化轨道类型为
③此配离子中含有的化学键类型为
A.离子键 B.金属键 C.共价键 D.配位键 E.σ键 F.π键
(2)
 与钴盐形成的配离子
与钴盐形成的配离子 可用于检验
可用于检验 的存在。
的存在。 离子的VSEPR模型名称为
离子的VSEPR模型名称为(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物
 和
和 ,其中适合作录音带磁粉原料的是
,其中适合作录音带磁粉原料的是(4)锰的一种配合物的化学式为
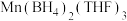 。已知:原子个数和价电子总数分别对应相等的分子、离子或基团称为等电子体。请写出两种与
。已知:原子个数和价电子总数分别对应相等的分子、离子或基团称为等电子体。请写出两种与 互为等电子体的微粒
互为等电子体的微粒(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为
 ,用
,用 表示阿伏加德罗常数的值,则晶胞的边长为
表示阿伏加德罗常数的值,则晶胞的边长为
您最近一年使用:0次
解题方法
6 . 某小组探究 与
与 溶液的反应。
溶液的反应。
(1)小组同学预测向 溶液中通入
溶液中通入 ,溶液颜色将由黄色变为浅绿色,预测的依据是
,溶液颜色将由黄色变为浅绿色,预测的依据是___ 。
进行实验
资料: 与
与 可以发生可逆反应,形成红棕色的配离子
可以发生可逆反应,形成红棕色的配离子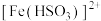 。
。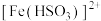 可以将
可以将 还原为
还原为 。
。
(2) 的空间结构是
的空间结构是__________ ,Fe在周期表中属于______________ 区。
(3) 与
与 可以形成配离子的原因是
可以形成配离子的原因是______________________ 。
(4) 溶液中通入
溶液中通入 至饱和,形成
至饱和,形成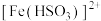 配离子的方程式是
配离子的方程式是_________________ 。
(5)溶液中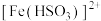 将
将 还原为
还原为 的离子方程式是
的离子方程式是______________________ 。
(6)由实验现象分析,溶液先变为红色,最后慢慢变为浅绿色的可能原因是________ 。
 与
与 溶液的反应。
溶液的反应。(1)小组同学预测向
 溶液中通入
溶液中通入 ,溶液颜色将由黄色变为浅绿色,预测的依据是
,溶液颜色将由黄色变为浅绿色,预测的依据是进行实验
实验装置(夹持仪器略) | 实验现象 |
| 向 溶液中通入 溶液中通入 至饱和,溶液变为红色,静置5min后,溶液的颜色从红色慢慢变为黄色,静置9h后,溶液慢慢由黄色变为浅绿色。 至饱和,溶液变为红色,静置5min后,溶液的颜色从红色慢慢变为黄色,静置9h后,溶液慢慢由黄色变为浅绿色。 |
 与
与 可以发生可逆反应,形成红棕色的配离子
可以发生可逆反应,形成红棕色的配离子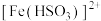 。
。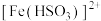 可以将
可以将 还原为
还原为 。
。(2)
 的空间结构是
的空间结构是(3)
 与
与 可以形成配离子的原因是
可以形成配离子的原因是(4)
 溶液中通入
溶液中通入 至饱和,形成
至饱和,形成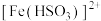 配离子的方程式是
配离子的方程式是(5)溶液中
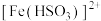 将
将 还原为
还原为 的离子方程式是
的离子方程式是(6)由实验现象分析,溶液先变为红色,最后慢慢变为浅绿色的可能原因是
您最近一年使用:0次
解题方法
7 . A、B、C、D、E是原子序数依次增大的五种元素,且原子序数均小于30、A的基态原子2p能级有3个电子;C的基态原子2p能级有1个未成对电子;基态D原子的结构示意图为 ;E的原子最外层有1个单电子,其次外层有3个能级且均排满电子。
;E的原子最外层有1个单电子,其次外层有3个能级且均排满电子。
(1)A元素是_________ ,在周期表中的位置是______________ 。
(2)B元素的氢化物在同主族元素的氢化物中沸点最高,原因是________________ 。
(3)A的最简单氢化物分子的空间构型为______ 。
(4)向E的硫酸盐溶液中通入A的最简单氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出深蓝色晶体。
①产生蓝色沉淀的离子方程式是____________________ 。
②深蓝色溶液中的深蓝色是由于存在______________ (填化学式),加入乙醇的目的是____________ 。
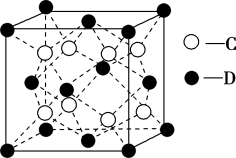
(5)C和D形成的化合物甲的晶胞结构如图,甲的化学式是______________ ,晶体中距离D最近的C有_______ 个。已知晶体的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,求晶胞边长a=
,求晶胞边长a=____ cm(用含ρ、 的计算式表示)。
的计算式表示)。
 ;E的原子最外层有1个单电子,其次外层有3个能级且均排满电子。
;E的原子最外层有1个单电子,其次外层有3个能级且均排满电子。(1)A元素是
(2)B元素的氢化物在同主族元素的氢化物中沸点最高,原因是
(3)A的最简单氢化物分子的空间构型为
(4)向E的硫酸盐溶液中通入A的最简单氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出深蓝色晶体。
①产生蓝色沉淀的离子方程式是
②深蓝色溶液中的深蓝色是由于存在
(5)C和D形成的化合物甲的晶胞结构如图,甲的化学式是
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,求晶胞边长a=
,求晶胞边长a= 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
8 . 硫酸镍溶于氨水形成 蓝色溶液。
蓝色溶液。
(1) 中阴离子的空间结构是
中阴离子的空间结构是_______ 。
(2)在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ 。
(3)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,再加入氨水。
①上述实验过程中观察到的现象是_______ 。
②用平衡移动的理论解释加入氨水后,现象发生变化的原因是_______ 。
 蓝色溶液。
蓝色溶液。(1)
 中阴离子的空间结构是
中阴离子的空间结构是(2)在
 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为(3)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,再加入氨水。
①上述实验过程中观察到的现象是
②用平衡移动的理论解释加入氨水后,现象发生变化的原因是
您最近一年使用:0次
解题方法
9 . 电负性与电离能是两种定量描述元素原子得失电子能力的参数,请回答下列问题:
(1)非金属性强弱:O_______ Cl(填“>”或“<”)。
(2)通过分析电负性的变化规律,确定Mg元素电负性的最小范围_______ 。
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确 的是_______ (选填字母序号)。
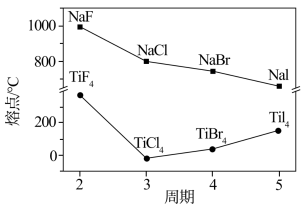
a.NaX均为离子晶体
b.随X半径增大,NaX离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)二氟化氧(OF2)的结构式为F—O—F,氧元素的化合价为_______ ,该分子属于_______ 分子(填“极性”或“非极性”)。
(5)已知苯可与ICl发生取代反应,利用电负性相关知识预测反应产物:_______
 +I-Cl
+I-Cl _______ + _______
_______ + _______
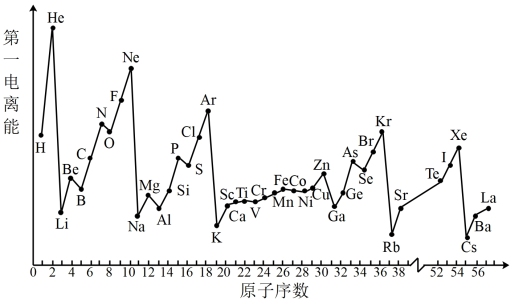
(6)随着原子序数的递增,元素气态基态原子的第一电离能呈现起伏变化,而电负性的规律性更强。结合原子核外电子排布式解释N的第一电离能比O的高的原因_______ 。
| 元素符号 | H | C | O | F | Mg | Al | Cl | Na |
| 电负性 | 2.1 | 2.5 | 3.5 | 4.0 | 1.5 | 3.0 | 0.9 |
(2)通过分析电负性的变化规律,确定Mg元素电负性的最小范围
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断

a.NaX均为离子晶体
b.随X半径增大,NaX离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)二氟化氧(OF2)的结构式为F—O—F,氧元素的化合价为
(5)已知苯可与ICl发生取代反应,利用电负性相关知识预测反应产物:
 +I-Cl
+I-Cl _______ + _______
_______ + _______(6)随着原子序数的递增,元素气态基态原子的第一电离能呈现起伏变化,而电负性的规律性更强。结合原子核外电子排布式解释N的第一电离能比O的高的原因

您最近一年使用:0次
名校
解题方法
10 . A、B、C、D 4种短周期元素,原子序数依次增大。其元素相关信息如下表。
(1)元素A、B、C中,电负性最大的是_______ (填元素符号)。
(2)A与B形成共价化合物 ,其分子的空间结构呈
,其分子的空间结构呈_______ 形。
(3) 易溶于
易溶于 中的原因是
中的原因是_______ 。
(4)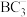 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为_______ ; 的空间结构为
的空间结构为_______ 。
(5)B和D两种元素组成的化合物是共价晶体,其晶胞如下图所示,则表示该化合物的化学式为_______ (请用元素符号表示)。
| 元素 | 信息 |
| A | 元素原子的核外电子只有一种运动状态 |
| B | 价电子层中的未成对电子有3个 |
| C | 最外层电子数为其内层电子数的3倍 |
| D | 离子半径在同周期金属元素中最小 |
(1)元素A、B、C中,电负性最大的是
(2)A与B形成共价化合物
 ,其分子的空间结构呈
,其分子的空间结构呈(3)
 易溶于
易溶于 中的原因是
中的原因是(4)
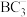 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为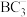 的空间结构为
的空间结构为(5)B和D两种元素组成的化合物是共价晶体,其晶胞如下图所示,则表示该化合物的化学式为

您最近一年使用:0次
2021-07-20更新
|
215次组卷
|
2卷引用:北京市密云区2020-2021学年高二下学期期末考试化学试题