解题方法
1 . 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要元素,也是重要的非金属元素。回答下列问题:
(1)基态磷原子的价层电子排布式为___________ 。
(2)N和P同主族:
①酸性:
___________ (填“>”或“<”) 。
。
② 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
③ 与水反应的化学方程式为
与水反应的化学方程式为___________ 。
(3)将磷酸加强热可发生分子间脱水反应生成焦磷酸(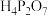 ,结构如图所示)、连三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是
,结构如图所示)、连三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是___________ 。 为阿伏加德罗常数的值,磷化硼晶体的密度为
为阿伏加德罗常数的值,磷化硼晶体的密度为 。
。___________ (用含 、
、 的代数式表示)cm。
的代数式表示)cm。
②估测该晶体的熔点___________ (填“高于”或“低于”)石墨。
③a原子的参数坐标为___________ 。
(1)基态磷原子的价层电子排布式为
(2)N和P同主族:
①酸性:

 。
。②
 的VSEPR模型名称为
的VSEPR模型名称为③
 与水反应的化学方程式为
与水反应的化学方程式为(3)将磷酸加强热可发生分子间脱水反应生成焦磷酸(
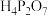 ,结构如图所示)、连三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是
,结构如图所示)、连三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是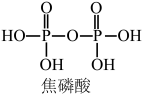
 为阿伏加德罗常数的值,磷化硼晶体的密度为
为阿伏加德罗常数的值,磷化硼晶体的密度为 。
。
 、
、 的代数式表示)cm。
的代数式表示)cm。②估测该晶体的熔点
③a原子的参数坐标为
您最近一年使用:0次
名校
解题方法
2 . 填空
(1)某化合物的晶胞如图,其化学式是___________ ,晶体类型是___________ 。 大
大 键。
键。
①产物中___________ (填“ ”或“
”或“ ”)位置的N原子更容易形成配位键。
”)位置的N原子更容易形成配位键。
②反应物中氮氮键键长___________ 产物中氮氮键键长(填“>”“<”或“=”),原因是_________ 。
(3)①已知 中含有大
中含有大 键
键 则
则 、
、 与
与 的键角由小到大的顺序为
的键角由小到大的顺序为_______ 。
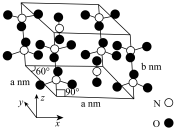
②氮的某种氧化物晶胞结构如图所示,由两种离子构成。阴阳离子中N原子的杂化类型分别为___________ ,晶体密度为___________ 。
(1)某化合物的晶胞如图,其化学式是
 大
大 键。
键。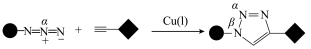
①产物中
 ”或“
”或“ ”)位置的N原子更容易形成配位键。
”)位置的N原子更容易形成配位键。②反应物中氮氮键键长
(3)①已知
 中含有大
中含有大 键
键 则
则 、
、 与
与 的键角由小到大的顺序为
的键角由小到大的顺序为②氮的某种氧化物晶胞结构如图所示,由两种离子构成。阴阳离子中N原子的杂化类型分别为
您最近一年使用:0次
解题方法
3 . 硼化合物及其材料在化工、医疗、材料等领域都起着举足轻重的作用。氨硼烷在催化剂作用下水解生成氢气的离子反应为 。回答下列问题:
。回答下列问题:
(1) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 ,则H、B、N三种元素的电负性大小顺序是
,则H、B、N三种元素的电负性大小顺序是___________ 。基态N原于的价层电子排布图为___________ 。B原于核外有___________ 种不同运动状态的电子。 分子中
分子中 键角
键角___________ (填“>”“<”或“=”) 分子中
分子中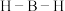 键角。
键角。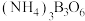 的熔点比
的熔点比 高的原因是
高的原因是___________ 。
(2)硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,如图所示是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上,则硼化镁的化学式为___________ 。___________ 。___________ ,该结构中有一个配位键,提供空轨道的原子是___________ 。若其晶胞参数为bpm,则该晶体的密度为___________  (列出表达式,设
(列出表达式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 。回答下列问题:
。回答下列问题:(1)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 ,则H、B、N三种元素的电负性大小顺序是
,则H、B、N三种元素的电负性大小顺序是 分子中
分子中 键角
键角 分子中
分子中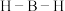 键角。
键角。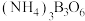 的熔点比
的熔点比 高的原因是
高的原因是(2)硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,如图所示是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上,则硼化镁的化学式为


 (列出表达式,设
(列出表达式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
4 .  汽车尾气处理系统的原理是利用
汽车尾气处理系统的原理是利用 脱除
脱除 并转化为
并转化为 。
。
(1)已知在25℃, 时:
时:
反应ⅰ: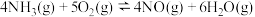

反应ⅱ: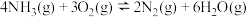
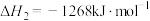
反应ⅲ:

________ 
(2)当 与
与 的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为
的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为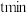 ,
, 的脱除率随温度变化的曲线如下图所示:
的脱除率随温度变化的曲线如下图所示: 与
与 的物质的量之比为
的物质的量之比为________ 。
②若曲线a中 的起始浓度为
的起始浓度为 ,则在900℃时
,则在900℃时 的脱除速率为
的脱除速率为________  。
。
③在800℃~1100℃时,催化剂活性较稳定。则 脱除的最佳温度为
脱除的最佳温度为________ ℃, 的脱除率在最佳温度之前逐渐增大的原因是
的脱除率在最佳温度之前逐渐增大的原因是________ 。
④940℃时,反应ⅲ的平衡常数
________ (用物质的量分数代替浓度,列计算式)。
⑤若其它条件不变,提高催化剂的活性,940℃时 的脱除率
的脱除率________ (选填“增大”“减小”或“不变”)。
(3)一定比例的 和
和 也能很好的脱除
也能很好的脱除 ,某催化反应机理如下图所示:
,某催化反应机理如下图所示: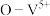 表示V化合价为
表示V化合价为 价,其它相似)
价,其它相似)
①该反应的催化剂为________ 。
② 转化为
转化为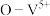 过程中
过程中 与
与 的物质的量比为
的物质的量比为________ 。
③ 转化为
转化为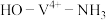 ,
, 键角增大的原因是
键角增大的原因是________ 。
 汽车尾气处理系统的原理是利用
汽车尾气处理系统的原理是利用 脱除
脱除 并转化为
并转化为 。
。(1)已知在25℃,
 时:
时:反应ⅰ:
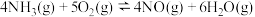

反应ⅱ:
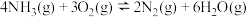
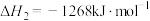
反应ⅲ:



(2)当
 与
与 的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为
的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为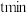 ,
, 的脱除率随温度变化的曲线如下图所示:
的脱除率随温度变化的曲线如下图所示:
 与
与 的物质的量之比为
的物质的量之比为②若曲线a中
 的起始浓度为
的起始浓度为 ,则在900℃时
,则在900℃时 的脱除速率为
的脱除速率为 。
。③在800℃~1100℃时,催化剂活性较稳定。则
 脱除的最佳温度为
脱除的最佳温度为 的脱除率在最佳温度之前逐渐增大的原因是
的脱除率在最佳温度之前逐渐增大的原因是④940℃时,反应ⅲ的平衡常数

⑤若其它条件不变,提高催化剂的活性,940℃时
 的脱除率
的脱除率(3)一定比例的
 和
和 也能很好的脱除
也能很好的脱除 ,某催化反应机理如下图所示:
,某催化反应机理如下图所示:
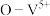 表示V化合价为
表示V化合价为 价,其它相似)
价,其它相似)①该反应的催化剂为
②
 转化为
转化为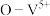 过程中
过程中 与
与 的物质的量比为
的物质的量比为③
 转化为
转化为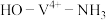 ,
, 键角增大的原因是
键角增大的原因是
您最近一年使用:0次
5 . 利用钛铁矿(主要成分为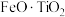 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: (
(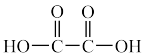 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为___________ 、___________ 。
(2) 、
、 的熔、沸点:
的熔、沸点: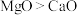 ,原因为
,原因为___________ 。
(3)已知 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。
① 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
②从原子结构角度预测 具有较强的还原性,原因为
具有较强的还原性,原因为___________ 。
③配合物 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角___________ (填“>”“<”或“=”) 中的,原因是
中的,原因是___________ 。
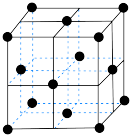
(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为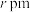 ,则
,则 原子的配位数为
原子的配位数为___________ ,该晶体的密度为___________ (列出计算式) 。
。
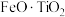 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: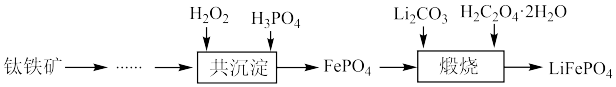
 (
(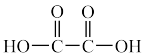 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为(2)
 、
、 的熔、沸点:
的熔、沸点: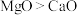 ,原因为
,原因为(3)已知
 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。①
 的VSEPR模型名称为
的VSEPR模型名称为②从原子结构角度预测
 具有较强的还原性,原因为
具有较强的还原性,原因为③配合物
 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角 中的,原因是
中的,原因是(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为
 ,则
,则 原子的配位数为
原子的配位数为 。
。
您最近一年使用:0次
2024-05-24更新
|
104次组卷
|
4卷引用:四川省雅安市2023-2024学年高三下学期5月联考理综试题-高中化学
名校
解题方法
6 . 铁及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态Fe原子核外电子排布式为___________ 。
(2) 可与
可与 形成配离子
形成配离子 ,
, 可与NO形成配离子
可与NO形成配离子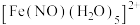 。
。
①S、N、O三种元素第一电离能由大到小的顺序为___________ 。
②每个 中含有σ键的数目是
中含有σ键的数目是___________ 。
(3) 的结构如图1所示。
的结构如图1所示。___________
②H2O中H-O-H键角___________ (填“>”“<”或“=”) 中O-S-O键角。
中O-S-O键角。
(4)由铁铜硫形成的某化合物的晶胞结构如图2所示。___________ 。
②若该晶体的密度为ρ g⋅cm ,则该晶胞的底面边长a=
,则该晶胞的底面边长a=___________ pm( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态Fe原子核外电子排布式为
(2)
 可与
可与 形成配离子
形成配离子 ,
, 可与NO形成配离子
可与NO形成配离子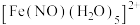 。
。①S、N、O三种元素第一电离能由大到小的顺序为
②每个
 中含有σ键的数目是
中含有σ键的数目是(3)
 的结构如图1所示。
的结构如图1所示。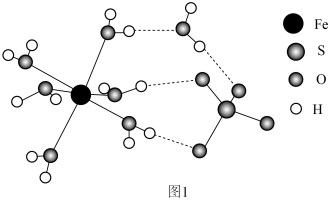
②H2O中H-O-H键角
 中O-S-O键角。
中O-S-O键角。(4)由铁铜硫形成的某化合物的晶胞结构如图2所示。
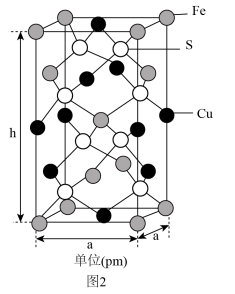
②若该晶体的密度为ρ g⋅cm
 ,则该晶胞的底面边长a=
,则该晶胞的底面边长a= 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
7 . 某大学教授课题研究组首次合成了石墨二炔—氧化铟(GDY—IO)纳米复合材料,并将其应用于气相光催化还原 制得
制得 碳氢化合物。
碳氢化合物。______ 。
(2)石墨二炔可以被看作是石墨烯中三分之一的C—C中插入两个 (二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有
(二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有______ 。
(3)石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为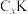 ,其平面图形如图1所示,x的值为
,其平面图形如图1所示,x的值为______ ;在石墨片层结构中,碳原子、C—C键、六元环的个数之比为______ 。 易与铁触媒作用导致其失去催化活性:
易与铁触媒作用导致其失去催化活性: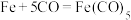 ,
, 又名羟基铁,常温下为黄色油状液体,则
又名羟基铁,常温下为黄色油状液体,则 的晶体类型是
的晶体类型是______ 。
(5)乙烯分子中碳碳双键与碳氢键间的键角大于碳氢键之间的键角,原因是____________ 。
(6)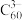 与
与 能形成图2中的超分子加合物,已知晶胞参数为
能形成图2中的超分子加合物,已知晶胞参数为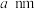 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为______  (列出计算表达式)。
(列出计算表达式)。
 制得
制得 碳氢化合物。
碳氢化合物。
(2)石墨二炔可以被看作是石墨烯中三分之一的C—C中插入两个
 (二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有
(二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有(3)石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为
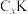 ,其平面图形如图1所示,x的值为
,其平面图形如图1所示,x的值为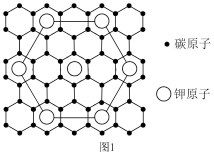
 易与铁触媒作用导致其失去催化活性:
易与铁触媒作用导致其失去催化活性: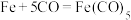 ,
, 又名羟基铁,常温下为黄色油状液体,则
又名羟基铁,常温下为黄色油状液体,则 的晶体类型是
的晶体类型是(5)乙烯分子中碳碳双键与碳氢键间的键角大于碳氢键之间的键角,原因是
(6)
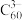 与
与 能形成图2中的超分子加合物,已知晶胞参数为
能形成图2中的超分子加合物,已知晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
名校
8 . 光伏材料又称太阳能材料,是指能将太阳能直接转换成电能的材料。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAlAs、InP、CdS 等。回答下列问题:
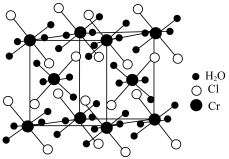
(1)基态Cr原子的价电子排布式为___________ 。
(2)原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为___________ 。
(3)基态P原子中电子占据的最高能层符号为___________ ; 的空间结构为
的空间结构为___________ 。
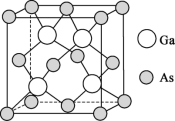
(4)砷化镓薄膜太阳能电池被用来为“天宫”空间站的核心舱供电。已知砷化镓的熔点为1238℃,其晶胞结构如下图所示。___________ 。
②该晶体的类型为___________ ;若晶胞密度为d  ,摩尔质量为M
,摩尔质量为M  ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为___________ nm(只列计算式)。
(1)基态Cr原子的价电子排布式为
(2)原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为(3)基态P原子中电子占据的最高能层符号为
 的空间结构为
的空间结构为(4)砷化镓薄膜太阳能电池被用来为“天宫”空间站的核心舱供电。已知砷化镓的熔点为1238℃,其晶胞结构如下图所示。
②该晶体的类型为
 ,摩尔质量为M
,摩尔质量为M  ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
您最近一年使用:0次
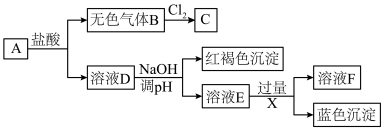
9 . 某固体混合物A由FeSO4、ZnCl2和Cu(NO3)2组成,3种物质的物质的量之比为1∶1∶1。进行如下实验:
②一些阳离子的开始沉淀至完全沉淀的范围:Fe2+(6.3~8.3)、Fe3+(1.5~2.8)、Zn2+(5.4~8.0)、Cu2+(4.7~6.2)。
③Ag2SO4微溶于硝酸。
请回答:
(1)气体B的主要成分为_____________ ,2mol气体B与1mol Cl2化合生成2mol C,C的空间构型为_____________ 。
(2)溶液F中除OH-、Cl-外的阴离子还有_____________ 。
(3)下列说法正确的是 。
(4)请设计实验检验A中的氯离子_______________ 。
(5)新制蓝色沉淀的悬浊液中通入SO2,产生紫红色固体,写出该反应离子方程式:_____________ 。
②一些阳离子的开始沉淀至完全沉淀的范围:Fe2+(6.3~8.3)、Fe3+(1.5~2.8)、Zn2+(5.4~8.0)、Cu2+(4.7~6.2)。
③Ag2SO4微溶于硝酸。
请回答:
(1)气体B的主要成分为
(2)溶液F中除OH-、Cl-外的阴离子还有
(3)下列说法正确的是 。
A.根据实验中的转化关系可得: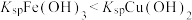 |
| B.调pH范围应控制在2.8~5.4 |
| C.X可以使用氨水或NaOH |
| D.气体B是形成光化学烟雾的罪魁祸首之一 |
(4)请设计实验检验A中的氯离子
(5)新制蓝色沉淀的悬浊液中通入SO2,产生紫红色固体,写出该反应离子方程式:
您最近一年使用:0次
解题方法
10 . 偏磷酸钡Ba(PO3)2具有耐高温、透光性良好等性能,是制备磷酸盐光学玻璃的基础物质。利用湿法磷酸(主要成分为H3PO4,含有少量Mg2+、Fe3+、 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示: 时:①
时:①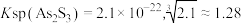 ;
;
②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为___________ 。
(2)“滤渣2”的主要成分有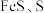 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为___________ ; 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为___________  [当
[当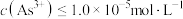 时认为沉淀完全]。
时认为沉淀完全]。
(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为___________ (填化学式)。
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是___________ 。
(5)“结晶”后得到 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为___________ ;比较 键角:
键角: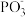
_________  (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是___________ 。
 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
 时:①
时:①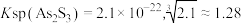 ;
;②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为
(2)“滤渣2”的主要成分有
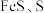 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为 [当
[当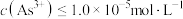 时认为沉淀完全]。
时认为沉淀完全]。(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是
(5)“结晶”后得到
 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为 键角:
键角: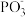
 (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是
您最近一年使用:0次
2024-04-15更新
|
250次组卷
|
3卷引用:2024届贵州省高三下学期二模化学试题



