名校
解题方法
1 . 下列说法正确的是
A.最外层都只有 个电子的元素原子性质一定相似 个电子的元素原子性质一定相似 |
| B.同一周期元素中,第一电离能随原子序数增加而增大 |
C. 晶体中存在 晶体中存在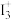 离子, 离子,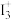 离子的几何构型为 离子的几何构型为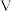 形 形 |
D. 是一种含有极性键和非极性键的非极性分子 是一种含有极性键和非极性键的非极性分子 |
您最近一年使用:0次
2022-03-22更新
|
159次组卷
|
3卷引用:天津市十二区县重点学校2020届高三毕业班联考(一)化学试题
名校
解题方法
2 . 镍能形成多种配合物如正四面体形的 、正方形的
、正方形的 和正八面体形的
和正八面体形的 等。下列说法不正确的是
等。下列说法不正确的是
 、正方形的
、正方形的 和正八面体形的
和正八面体形的 等。下列说法不正确的是
等。下列说法不正确的是A. 分子内σ键和π键个数之比为1:2 分子内σ键和π键个数之比为1:2 |
B. 的空间结构为三角锥形 的空间结构为三角锥形 |
C. 在形成配合物时,其配位数只能为4 在形成配合物时,其配位数只能为4 |
D. 中,镍元素是 中,镍元素是 杂化 杂化 |
您最近一年使用:0次
2021-09-29更新
|
571次组卷
|
4卷引用:2020年天津卷化学高考真题变式题1-12
(已下线)2020年天津卷化学高考真题变式题1-122021年山东高考化学试题变式题1-10河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题(已下线)第3.4讲 配合物与超分子-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
解题方法
3 . 2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)Mn位于元素周期表的_______ 区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为_______ ,1mol [CoCl (NH3)5] Cl2 中含σ键数目为_______ NA。
(2)PH3是_______ 分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是_______ 。
(3)硫酸镍溶于氨水形成 蓝色溶液。
蓝色溶液。
① 中阴离子的立体构型是
中阴离子的立体构型是_______ 。
②向硫酸铜溶液逐滴加入氨水,会先生成难溶物而后溶解也能形成深蓝色溶液,写出难溶物溶于氨水的离子方程式:_______ 。
③单质铜及镍都是由_______ 键形成的晶体;元素铜与镍的第二电离能分别为: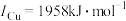 ,
, ,
,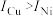 的原因是
的原因是_______ 。
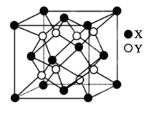
(4)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是_______ nm。(用含a、M、NA的计算式表示)
(1)Mn位于元素周期表的
(2)PH3是
(3)硫酸镍溶于氨水形成
 蓝色溶液。
蓝色溶液。①
 中阴离子的立体构型是
中阴离子的立体构型是②向硫酸铜溶液逐滴加入氨水,会先生成难溶物而后溶解也能形成深蓝色溶液,写出难溶物溶于氨水的离子方程式:
③单质铜及镍都是由
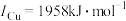 ,
, ,
,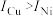 的原因是
的原因是(4)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是

您最近一年使用:0次
4 . 下列叙述中正确的是
| A.NH3、CO、CO2都是极性分子 |
| B.CH4、CCl4都是含有极性键的非极性分子 |
| C.HF、HCl、HBr、HI的稳定性依次增强 |
| D.CS2、H2O、C2H2都是直线形分子 |
您最近一年使用:0次
2022-10-18更新
|
2634次组卷
|
79卷引用:2008年理综全国卷Ⅰ高考试题化学试题
2008年理综全国卷Ⅰ高考试题化学试题(已下线)2012届广西桂林十八中高三第一次月考化学试卷(已下线)2013届山西省山西大学附中高三9月月考化学试卷上海市青浦二中2016届高三上学期8月摸底考试化学试题福建省龙岩市武平县第一中学2021届高三上学期10月月考化学试题(已下线)2011-2012学年山西大同实验中学高二下学期期中考试化学试卷(已下线)2011-2012学年新疆农七师高级中学高二下学期期末考试试化学试卷(已下线)2011-2012学年福建省漳州立人学校高二下学期期中考试化学试卷(已下线)2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(已下线)2012-2013学年河北省唐山市第一中学高二下学期期末考试化学试卷2013-2014山东省即墨市高二下学期期中考试化学试卷2015-2016学年重庆市第八中学高二下第三次月考化学试卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年内蒙古元平煤高中高二实验班下期中化学卷2015-2016学年重庆四十二中高一下期中化学试卷(已下线)同步君 选修3 第二章 第三节 键的极性和分子的极性2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷2016-2017学年山东省淄博市高青一中、淄博实验中学高二下学期期中联考化学试卷新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题陕西省黄陵中学2016-2017学年高二(重点班)下学期第三学月考化学试题河南省焦作市博爱一中2016-2017学年高二下学期第一次月考化学试题高中化学人教版 选修三 第2章 分子结构与性质 键的极性和分子的极性(已下线)【段考模拟】高二化学下学期第一次月考(3月)原创B卷宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题陕西省黄陵中学2017-2018学年高二(重点班)下学期期末考试化学试题云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题云南省元江哈尼族彝族傣族自治县一中2018-2019学年高二上学期12月考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题(已下线)2019年6月12日 《每日一题》 选修3-物质类别、键的极性及分子的极性之间的关系安徽省淮北师范大学附属实验中学2018-2019学年高二下学期第二次月考化学试题吉林省长春市汽车经济开发区第三中学2018-2019学年高二下学期期中考试化学试题云南省普洱市孟连县一中2018-2019学年高二下学期期末考试化学试题云南省鹤庆三中2018-2019学年高二下学期期末考试化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期线上检测化学试题河北省唐山市路北区第十一中学2019-2020学年高二期中考试化学试题辽宁省六校协作体2019-2020高二下学期期初考试化学试卷吉林省舒兰市实验中学2019-2020学年高二下学期期中考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题安徽省六安中学2019-2020学年高二下学期期末考试化学试题新疆昌吉回族自治州呼图壁县第一中学2019-2020学年高二下学期期末考试化学试题福建省龙海市第二中学2019-2020学年高二下学期期末考试化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题四川省绵阳市江油中学2020-2021学年高二上学期期中考试化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题黑龙江省哈尔滨市第三十二中学2019-2020学年高二下学期期中考试化学试题宁夏吴忠市吴忠中学2022-2023学年高三上学期阶段性测试 化学试题(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 章末综合检测卷辽宁省阜新二高2020-2021学年高二下学期期中考试化学试题云南省通海县一中2020-2021学年高二下学期期中考试化学试题人教2019选择性必修2第二章 分子结构与性质复习与提高黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期中考试化学试题陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题福建省南安市侨光中学、昌财实验中学2021-2022学年高二下学期第4次联考(期中)化学试题宁夏贺兰县景博中学2021-2022学年高二下学期第一次月考化学试题四川省绵阳市盐亭中学2022-2023学年高二上学期第一次月考教学质量检测化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章03单元测山东省威海市文登新一中2021-2022学年高二上学期期中考试化学试题广东省广州市第三中学2022-2023学年高二上学期期末测试化学试题广东省台山市第一中学2022-2023学年高二下学期第一次月考化学试题江西省景德镇市2022-2023学年高二下学期4月期中测试化学试题广东省深圳市观澜中学2022-2023学年高二下学期月考(物质结构)化学试题福建省德化第二中学2022-2023学年高二下学期期中考试化学试题安徽省合肥市第七中学2022-2023学年高二下学期期中检测化学试题广东省珠海市第三中学2023-2024学年高二下学期3月月考化学试卷河北省衡水市枣强中学2023-2024学年高二下学期第一次调研考试化学试题河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题四川省富顺一中2023-2024学年高二下学期第一次月考化学试题广东省惠州市华罗庚中学2023-2024学年高二下学期3月月考化学试题广东梅州五华县中英文实验学校2023-2024学年高二下学期3月考试化学试题广东省汕尾市陆河县河田中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
5 . 用化学用语表示2H2S+3O2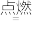 2SO2+2H2O中的相关微粒,其中正确的是
2SO2+2H2O中的相关微粒,其中正确的是
 2SO2+2H2O中的相关微粒,其中正确的是
2SO2+2H2O中的相关微粒,其中正确的是| A.H2S是极性分子 | B.H2O的分子空间构型:直线形 |
| C.H2S的沸点比H2O高 | D.H2O分子中所有原子满足8电子结构 |
您最近一年使用:0次
名校
解题方法
6 . 据报道,新疆南部发现稀有金属、铅、锌、铁、锰和金矿带约600 m。回答下列问题:
(1)基态锰的价层电子排布式为___________ ;预测:锰的第三电离能( )
)________ (填“大于”“小于”或“等于”)铁的第三电离能( )。
)。
(2)氧化锰能催化氧化HCHO生成 和
和 。
。
①等物质的量的HCHO、 分子中
分子中 键数目之比为
键数目之比为____________________ 。
②在HCHO、 、
、 中,空间构型呈V形的分子是
中,空间构型呈V形的分子是____________________ 。
③HCHO中C原子的杂化类型是____________________ 。
(3) [Zn(NH3)4]SO4中不存在的作用力类型是____________________ (填字母)。
A.非极性键 B.配位键 C.离子键 D.金属键
(4)配合物在水中的颜色与d轨道的分裂能有关。d轨道的分裂能是1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量。预测分裂能:
_______ (填“>”“<”或“=”) ,理由是
,理由是_________________ 。
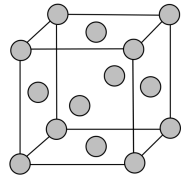
(5)铅晶胞如图所示。
已知:铅晶胞密度为 ,
, 代表阿伏加德罗常数的值。
代表阿伏加德罗常数的值。
晶胞中两个面心上铅原子的最短距离为__________________ pm。
(1)基态锰的价层电子排布式为
 )
) )。
)。(2)氧化锰能催化氧化HCHO生成
 和
和 。
。①等物质的量的HCHO、
 分子中
分子中 键数目之比为
键数目之比为②在HCHO、
 、
、 中,空间构型呈V形的分子是
中,空间构型呈V形的分子是③HCHO中C原子的杂化类型是
(3) [Zn(NH3)4]SO4中不存在的作用力类型是
A.非极性键 B.配位键 C.离子键 D.金属键
(4)配合物在水中的颜色与d轨道的分裂能有关。d轨道的分裂能是1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量。预测分裂能:

 ,理由是
,理由是(5)铅晶胞如图所示。
已知:铅晶胞密度为
 ,
, 代表阿伏加德罗常数的值。
代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为

您最近一年使用:0次
名校
解题方法
7 . 2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(Linus Pauling)教授诞辰100周年(1901~1994)。1994年这位世纪老人谢世,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。老人为什么画这个结构式?它是生命前物质?它能合成吗?它有什么性质?不得而知。这是鲍林留给世人的一个谜,也许这是永远无法解开的谜;也许你有朝一日能解开它,不管结果如何,让我们先对这个结构作一番考察:

(1)它的所有原子能否处于同一个平面上___________ (填“能”或“否”)。
(2)它是否带有电荷___________ (填“是”或“否”),C、N、O三种元素的第一电离能由小到大的顺序为___________ 。
(3)该分子中 杂化的N原子有
杂化的N原子有___________ 个。
(4)人们猜它是炸药的原因是___________ 。
(5)金属钼的晶胞结构如图所示,其晶胞堆积模型是___________ ;已知钼晶体密度为
 ,用
,用 表示阿伏加德罗常数的值,则金属钼的晶胞中两个钼原子的最小核间距为
表示阿伏加德罗常数的值,则金属钼的晶胞中两个钼原子的最小核间距为___________  。
。


(1)它的所有原子能否处于同一个平面上
(2)它是否带有电荷
(3)该分子中
 杂化的N原子有
杂化的N原子有(4)人们猜它是炸药的原因是
(5)金属钼的晶胞结构如图所示,其晶胞堆积模型是

 ,用
,用 表示阿伏加德罗常数的值,则金属钼的晶胞中两个钼原子的最小核间距为
表示阿伏加德罗常数的值,则金属钼的晶胞中两个钼原子的最小核间距为 。
。
您最近一年使用:0次
名校
解题方法
8 . 锂离子电池已破广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯无水溶液作电解液。回答下列问题:
(1)基态锂原子的电子排布图为________ 。基态磷原子子中,电子占据的最高能层符号为_____________ 。
(2)PO 的空间构型为
的空间构型为_______________ 。
(3)[Co(NH3)3Cl3]中Co3+的配位数为6,该配合物中的配位原子为____________ 。
(4)碳酸二乙酯的分子结构如图1所示,分子中所含元素的电负性由小到大的顺序为_____ ,分子中碳原子的杂化轨道类型为____ ,1 mol碳酸二乙酯中含有σ键的数目为_____ NA(NA为阿伏加德罗常数的值)。

(5)在元素周期表中,铁元素位于____ 区(填“s”“p”“d”或“ds”)。γ—Fe 的堆积方式如图2所示,其空间利用率为________ (用含π的式子表示)。
(6)氮化锂是一种新型无机贮氢材料,如图3所示,该晶体的化学式为____________ 。
(1)基态锂原子的电子排布图为
(2)PO
 的空间构型为
的空间构型为(3)[Co(NH3)3Cl3]中Co3+的配位数为6,该配合物中的配位原子为
(4)碳酸二乙酯的分子结构如图1所示,分子中所含元素的电负性由小到大的顺序为

(5)在元素周期表中,铁元素位于
(6)氮化锂是一种新型无机贮氢材料,如图3所示,该晶体的化学式为
您最近一年使用:0次
2020-12-31更新
|
231次组卷
|
3卷引用:安徽省皖南八校2021届高三第二次联考(12月)理综合化学试题
名校
解题方法
9 . 硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,回答下列问题:
(1)基态Ni2+的电子排布式为_______ 。
(2)①在1mol[Ni(NH3)6]2+中含有σ键的数目为_______ 。
②Ni、N、O三种元素的第一电离能由小到大的顺序是为_____ 。
③液氨中存在电离平衡2NH3⇌NH + NH
+ NH ,根据价层电子对互斥理论,可推知NH2—的空间构型为
,根据价层电子对互斥理论,可推知NH2—的空间构型为_______ ,液氨体系内,氮原子的杂化轨道类型为_____ 。NH3比PH3更容易液化的原因为_____ 。
(3)氧化镍晶胞如图所示,镍离子的配位数为_______ 。
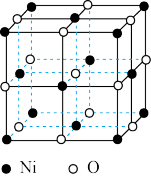
已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为______ g/cm3。
(1)基态Ni2+的电子排布式为
(2)①在1mol[Ni(NH3)6]2+中含有σ键的数目为
②Ni、N、O三种元素的第一电离能由小到大的顺序是为
③液氨中存在电离平衡2NH3⇌NH
 + NH
+ NH ,根据价层电子对互斥理论,可推知NH2—的空间构型为
,根据价层电子对互斥理论,可推知NH2—的空间构型为(3)氧化镍晶胞如图所示,镍离子的配位数为

已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为
您最近一年使用:0次
名校
10 . (1)尿素又称碳酰胺,在160℃分解为氨气和异氰酸,请写出尿素的结构式和氨气的空间构型___________ ;___________ 。
(2) 的沸点
的沸点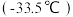 高于
高于 的沸点
的沸点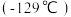 的主要原因是
的主要原因是___________ 。
(3) 可用于漂白和杀菌,请写出一定条件下
可用于漂白和杀菌,请写出一定条件下 与水反应的方程式
与水反应的方程式___________ 。
(2)
 的沸点
的沸点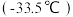 高于
高于 的沸点
的沸点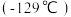 的主要原因是
的主要原因是(3)
 可用于漂白和杀菌,请写出一定条件下
可用于漂白和杀菌,请写出一定条件下 与水反应的方程式
与水反应的方程式
您最近一年使用:0次



