1 . 随着科学的发展,氟及其化合物的用途日益广泛。
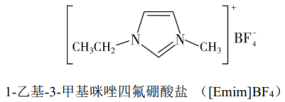
Ⅰ.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。
(1)基态N原子的价层电子轨道表示式为_______ 。
(2)①N、F、P三种元素的电负性由大到小的顺序为_______ 。
②根据VSEPR模型,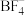 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为_______ ,空间结构为_______ 形。
(3) 是制备此离子液体的原料。
是制备此离子液体的原料。
①微粒中F—B—F键角:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 可以与NaF反应生成
可以与NaF反应生成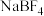 的原因是
的原因是_______ 。
(4)以 和
和 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为_______ ,电解质溶液中 向
向_______ (填“阴”或“阳”)极移动。
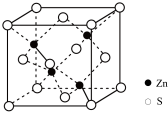
Ⅱ.NaF等氟化物可以做光导纤维材料,一定条件下,某NaF的晶胞结构示意图如下图所示,晶胞的边长为apm 。
。

(5)与 距离最近且相等的
距离最近且相等的 有
有_______ 个。
(6)已知NaF的摩尔质量是Mg/mol,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为_______  。
。
Ⅰ.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。

(1)基态N原子的价层电子轨道表示式为
(2)①N、F、P三种元素的电负性由大到小的顺序为
②根据VSEPR模型,
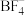 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为(3)
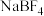 是制备此离子液体的原料。
是制备此离子液体的原料。①微粒中F—B—F键角:

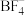 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 可以与NaF反应生成
可以与NaF反应生成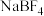 的原因是
的原因是(4)以
 和
和 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为 向
向Ⅱ.NaF等氟化物可以做光导纤维材料,一定条件下,某NaF的晶胞结构示意图如下图所示,晶胞的边长为apm
 。
。
(5)与
 距离最近且相等的
距离最近且相等的 有
有(6)已知NaF的摩尔质量是Mg/mol,阿伏伽德罗常数为
 。该晶体的密度为
。该晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
2 . 氟是卤族元素中原子半径最小的元素,氟的化合物种类繁多,用途广泛。回答下列问题:
(1)基态氟原子价电子的电子排布图为___________ ,其电子占据的最高能级的电子云轮廓图为___________ 。
(2) 和
和 均为离子晶体,其熔沸点如下表:
均为离子晶体,其熔沸点如下表:
 、
、 、
、 的离子半径从大到小顺序为
的离子半径从大到小顺序为___________ , 熔沸点比
熔沸点比 高的原因是
高的原因是___________ 。
(3)氟虫腈是一种广谱性杀虫剂,其结构简式如图甲:___________ 。晶体中不存在的化学键有___________ (填序号)
a.离子键 b. 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键
(4)全氟辛酸(如图乙)主要用作表面活性剂、乳化剂。全氟辛酸结构中,与每个碳原子(除羧基碳外)相连的F、C的空间构型为___________ (图中交叉点均为碳原子)。 具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为
具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为___________  。
。
(1)基态氟原子价电子的电子排布图为
(2)
 和
和 均为离子晶体,其熔沸点如下表:
均为离子晶体,其熔沸点如下表:| 熔点 | 沸点 | |
 | 993℃ | 1695℃ |
 | 1261℃ | 2260℃(分解) |
 、
、 、
、 的离子半径从大到小顺序为
的离子半径从大到小顺序为 熔沸点比
熔沸点比 高的原因是
高的原因是(3)氟虫腈是一种广谱性杀虫剂,其结构简式如图甲:

a.离子键 b.
 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键(4)全氟辛酸(如图乙)主要用作表面活性剂、乳化剂。全氟辛酸结构中,与每个碳原子(除羧基碳外)相连的F、C的空间构型为

 具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为
具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为 。
。
您最近一年使用:0次
名校
解题方法
3 . Ⅰ.物质的光学性质在科研中有重要的用途,回答下列问题:
一种比率光声探针M与 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示:________  中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为________ 。
(2)均为平面结构的吡咯( )和吡啶(
)和吡啶(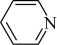 )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为________ ,原因是________ 。
Ⅱ.分析如图晶胞结构特点,回答下列问题:
(3)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。已知:立方氮化硼密度为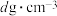 ,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为
,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为 ,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为
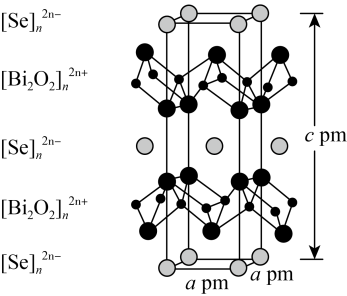
,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为________ (列出计算式即可,不用化简)。 层与带负电的
层与带负电的 层交替堆积。据此推断硒氧化铋的化学式为
层交替堆积。据此推断硒氧化铋的化学式为________ 。晶胞棱边夹角均为90°,则晶体密度的计算式为________  。
。
一种比率光声探针M与
 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示: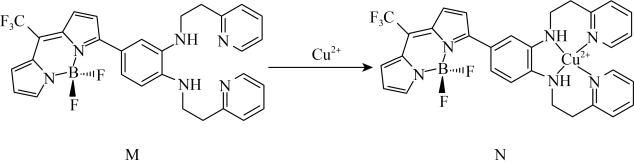
 中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为Ⅱ.分析如图晶胞结构特点,回答下列问题:
(3)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。已知:立方氮化硼密度为
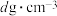 ,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为
,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为 ,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为
,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为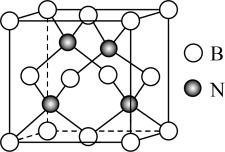
 层与带负电的
层与带负电的 层交替堆积。据此推断硒氧化铋的化学式为
层交替堆积。据此推断硒氧化铋的化学式为 。
。
您最近一年使用:0次
解题方法
4 . VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态Se原子的的核外电子排布式为___________
(2)O、S、Se原子的第一电离能由大到小的顺序为___________ 。
(3)H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是___________ 。
(4)H2Se的酸性比H2S________ (填“强”或“弱”),气态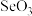 分子的立体构型为
分子的立体构型为_______ , 离子的中心原子的杂化类型为
离子的中心原子的杂化类型为___________ ;
(5) 在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方 晶体结构如下图所示,S原子的配位数是
晶体结构如下图所示,S原子的配位数是___________ ,已知晶胞边长为 ,NA代表阿伏加德罗常数,则其密度为
,NA代表阿伏加德罗常数,则其密度为___________ (列式并计算)。
(6)定影液的主要成分是 ,它能溶解胶皮上为感光的
,它能溶解胶皮上为感光的 ,从而起到一定影响作用,为使定影液再生,进行如下的处理:
,从而起到一定影响作用,为使定影液再生,进行如下的处理:
① 在
在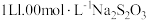 溶液中溶解的质量为
溶液中溶解的质量为___________ g。[已知 ,
,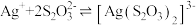 的平衡常数
的平衡常数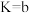 ]
]
②写定影液再生的离子方程式为___________ 。
(1)基态Se原子的的核外电子排布式为
(2)O、S、Se原子的第一电离能由大到小的顺序为
(3)H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是
(4)H2Se的酸性比H2S
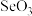 分子的立体构型为
分子的立体构型为 离子的中心原子的杂化类型为
离子的中心原子的杂化类型为(5)
 在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方 晶体结构如下图所示,S原子的配位数是
晶体结构如下图所示,S原子的配位数是 ,NA代表阿伏加德罗常数,则其密度为
,NA代表阿伏加德罗常数,则其密度为
(6)定影液的主要成分是
 ,它能溶解胶皮上为感光的
,它能溶解胶皮上为感光的 ,从而起到一定影响作用,为使定影液再生,进行如下的处理:
,从而起到一定影响作用,为使定影液再生,进行如下的处理:
①
 在
在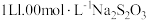 溶液中溶解的质量为
溶液中溶解的质量为 ,
,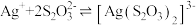 的平衡常数
的平衡常数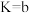 ]
]②写定影液再生的离子方程式为
您最近一年使用:0次
名校
5 . 镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为___________ 。
(2)LiGaH4是一种温和的还原剂,其可由GaCl3和过量的LiH反应制得: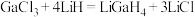 。
。
①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为___________ 。
② 的立体构型为
的立体构型为___________ 。
(3)一种含镓的药物合成方法如图所示:
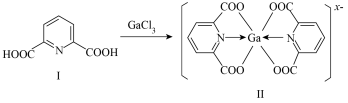
化合物Ⅰ中环上C原子的杂化方式为________ ,1mol化合物Ⅰ中含有的 键的物质的量为
键的物质的量为___________ 。
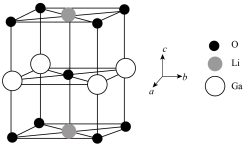
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
①上述晶胞沿着a轴的投影图为________ (填选项字母)。
A.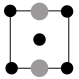 B.
B.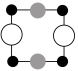 C.
C.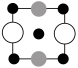
②用 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为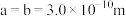 ,
,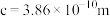 ,则其密度为
,则其密度为________  (列出计算式即可)。
(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)LiGaH4是一种温和的还原剂,其可由GaCl3和过量的LiH反应制得:
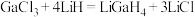 。
。①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
②
 的立体构型为
的立体构型为(3)一种含镓的药物合成方法如图所示:

化合物Ⅰ中环上C原子的杂化方式为
 键的物质的量为
键的物质的量为(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B. C.
C.
②用
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为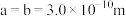 ,
,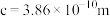 ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2023-06-30更新
|
93次组卷
|
2卷引用:广东省珠海市斗门第一中学2022-2023学年高二下学期6月月考化学试题
名校
解题方法
6 . 磷、碳、氢、氧等非金属及其化合物用途广泛。回答下列问题:
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为_______ 。(用NA表示阿伏伽德罗常数的值)
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为_______ 。
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为_______ ,产生的阳离子的空间结构为_______ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 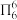 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为_______ ,一定在同一平面上的原子有_______ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,_______ 。
(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。
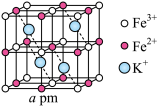
①该化合物的化学式为_______ 。
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为_______ pm;该晶体的密度为_______ g•cm-3(阿伏加德罗常数为NA)
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 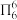 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。

①该化合物的化学式为
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为
您最近一年使用:0次
解题方法
7 . 镍的合金及其配合物用途非常广泛。回答下列问题:
(1)基态Ni原子的价电子排布式为___________ , 最高能级电子云轮廓图为___________ 形。
(2)Ni与Ca均位于第四周期,最外层电子数也相同,但Ni的熔点和沸点均比Ca的高,这是因为___________ 。
(3)镍可形成Ni(NH3)4(NCS)2、Ni(NH3)4 (NO2)2、K2[NiF4]等多种配合物。
①配体NCS-中,三种元素的电负性最大的是___________ 。
②配体 的空间构型为
的空间构型为___________ 形,中心原子的杂化方式是___________ 。
③K2[NiF4 ]可由反应NiF2 + 2KHF2=K2[NiF4]+2HF制取,KHF2晶体中所含的化学键类型有___________ (填字母)。
A.离子键 B.σ键 C.π键 D.非极性键
(4)Ni2 MnGa晶体的立方晶胞结构如图a所示。

①已知Ni2MnGa的晶胞参数为0.5822nm,设NA为阿伏加德罗常数的数值,则Ni2MnGa晶体的密度为___________ (列出计算式)g· cm-3。
②Ni2MnGa晶体的晶胞结构还可以用图b表示,若●表示的是Mn,则 表示的是
表示的是___________ ,⊕表示的是___________ 。

(1)基态Ni原子的价电子排布式为
(2)Ni与Ca均位于第四周期,最外层电子数也相同,但Ni的熔点和沸点均比Ca的高,这是因为
(3)镍可形成Ni(NH3)4(NCS)2、Ni(NH3)4 (NO2)2、K2[NiF4]等多种配合物。
①配体NCS-中,三种元素的电负性最大的是
②配体
 的空间构型为
的空间构型为③K2[NiF4 ]可由反应NiF2 + 2KHF2=K2[NiF4]+2HF制取,KHF2晶体中所含的化学键类型有
A.离子键 B.σ键 C.π键 D.非极性键
(4)Ni2 MnGa晶体的立方晶胞结构如图a所示。

①已知Ni2MnGa的晶胞参数为0.5822nm,设NA为阿伏加德罗常数的数值,则Ni2MnGa晶体的密度为
②Ni2MnGa晶体的晶胞结构还可以用图b表示,若●表示的是Mn,则
 表示的是
表示的是
您最近一年使用:0次
解题方法
8 . 氮元素形成的化合物种类众多,用途广泛。根据信息回答下列问题。
(1)NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350°C),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
①基态氮原子的电子排布图为________________ 。
②上述涉及的元素H、B 、C、N、O中电负性最大的是_____ (填元素符号)。
(2)BF3、NH3和PH3分子中键角由大到小的顺序为_____ 。
(3)若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=__________________ 。
(4)咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:
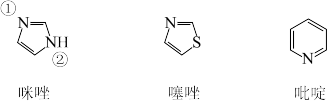
①上述三种物质中,沸点最高的是_____ (填化学名称)。
②吡啶中氮原子的杂化轨道的空间构型为_____________ 。
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是_____ (填“①”或“②” )号氮原子。
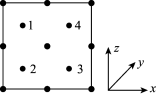
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( ,
, ,
, ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为________ 。
(6)某铁氮化合物晶体的晶胞结构如图所示。
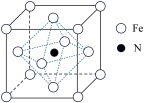
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_____ 。
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为____ g·cm-3(列出计算式即可)。
(1)NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350°C),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
①基态氮原子的电子排布图为
②上述涉及的元素H、B 、C、N、O中电负性最大的是
(2)BF3、NH3和PH3分子中键角由大到小的顺序为
(3)若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=
(4)咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:

①上述三种物质中,沸点最高的是
②吡啶中氮原子的杂化轨道的空间构型为
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(
 ,
, ,
, ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为
(6)某铁氮化合物晶体的晶胞结构如图所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
名校
解题方法
9 . 磷、碳、氢等非金属及其化合物用途广泛。试回答下列问题。
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为___________ 。
②研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为___________ ,产生的阳离子的空间结构为___________ ;N和P都有+5价,但NCl5不存在,从原子结构的角度分析其原因:___________ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 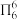 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为___________ ,一定在同一平面上的原子有___________ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,___________ 。
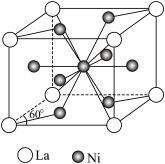
(3)镍镧合金(LaNin)具有很强的储氢能力,其晶胞结构如图所示,其中n=___________ 。 已知晶胞体积为9.0 ×10 -29 m3,若储氢后形成LaNinH5.5(氢进入晶胞空隙,晶胞体积不变),则氢在合金中的密度为___________ g·cm-3(保留1位小数)。
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
②研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 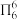 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)镍镧合金(LaNin)具有很强的储氢能力,其晶胞结构如图所示,其中n=
您最近一年使用:0次
2023-04-05更新
|
748次组卷
|
5卷引用:河南省普通高中2023届高三适应性考试理科综合化学试题
河南省普通高中2023届高三适应性考试理科综合化学试题(已下线)化学-2023年高考押题预测卷01(全国乙卷)(含考试版、全解全析、参考答案、答题卡)(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)2024届陕西省西安中学高三下学期第九次模拟考试理综试题-高中化学2024届陕西省西安市第一中学高三下学期第十六次模拟考试理综试题-高中化学
解题方法
10 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)Ag元素在元素周期表分区中属于_______ 区,基态Ag原子的价电子排布式为_______ 。
(2)硫代硫酸银(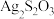 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成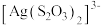 等络阴离子。
等络阴离子。
①依据 理论推测
理论推测 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
②在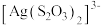 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ 。
(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有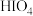 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和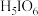 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性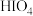
_______ 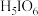 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是_______ 。
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
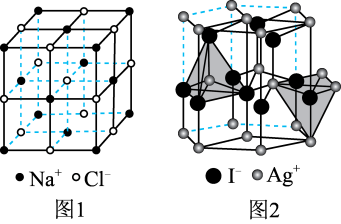
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为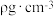 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______ ;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______ (储氢能力 )
)
(1)Ag元素在元素周期表分区中属于
(2)硫代硫酸银(
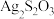 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成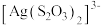 等络阴离子。
等络阴离子。①依据
 理论推测
理论推测 的空间构型为
的空间构型为②在
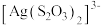 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有
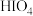 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和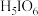 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性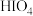
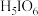 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为a.几何因素 b.电荷因素 c.键性因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为
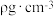 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )
)
您最近一年使用:0次
2022-04-25更新
|
1254次组卷
|
4卷引用:内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题
内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)【直抵名校】01-备战2022年高考化学名校进阶模拟卷(通用版)河南省南阳市2021-2022学年高二下学期期末考试化学试题



