1 . 设为 阿伏加德罗常数的值。下列叙述正确的是
阿伏加德罗常数的值。下列叙述正确的是
 阿伏加德罗常数的值。下列叙述正确的是
阿伏加德罗常数的值。下列叙述正确的是A.1mol 晶体中含阳离子数为 晶体中含阳离子数为 |
B.1mol乙醇( )分子中含 )分子中含 杂化的原子数为 杂化的原子数为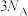 |
C.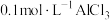 溶液中含 溶液中含 的数目小于 的数目小于 |
D.标准状况下,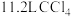 中含原子数为 中含原子数为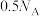 |
您最近一年使用:0次
2 . 马日夫盐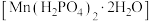 是一种白色晶体,易溶于水,常用于机械设备的磷化处理。下列说法正确的是
是一种白色晶体,易溶于水,常用于机械设备的磷化处理。下列说法正确的是
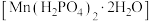 是一种白色晶体,易溶于水,常用于机械设备的磷化处理。下列说法正确的是
是一种白色晶体,易溶于水,常用于机械设备的磷化处理。下列说法正确的是A. 中氧原子的杂化轨道类型:sp 中氧原子的杂化轨道类型:sp |
| B.核电荷数:Mn>P>O>H |
| C.基态原子未成对电子数:P>O>Mn>H |
D.基态氧原子的 电子能量较高,其一定在比基态氧原子 电子能量较高,其一定在比基态氧原子 电子离核更远的地方运动 电子离核更远的地方运动 |
您最近一年使用:0次
2024-04-04更新
|
99次组卷
|
2卷引用:河北省邢台市四校联盟2023-2024学年高二上学期11月月考化学试题
解题方法
3 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(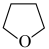 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: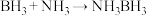 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
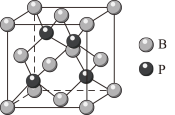
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: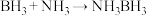 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
解题方法
4 . PF5常用作聚合反应的催化剂。PF5与水反应的一种反应历程如图所示。下列说法正确的是
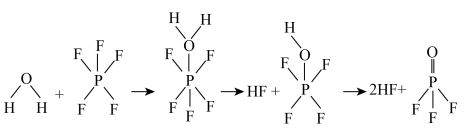

| A.沸点:HF>H2O |
| B.反应过程中有非极性键的断裂与形成 |
| C.PF5中心原子上的价层电子对数为5 |
| D.H2O分子中O原子的杂化类型为sp2 |
您最近一年使用:0次
名校
解题方法
5 . 苯甲酸常作食品防腐剂。一种合成路线如下:
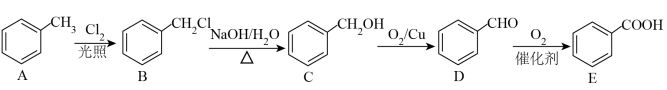
回答下列问题:
(1)A的分子式为___________ ,B、D中官能团名称是___________ 。
(2)上述五种有机物属于___________ (填字母)。
a.芳香烃 b.脂环化合物 c.芳香族化合物 d.脂肪烃衍生物
(3)A一溴代物有___________ 种。
(4)C中碳原子杂化类型是___________ 。
(5)C、D的沸点依次为204.7℃、179℃,二者沸点差异的主要原因是___________ 。
(6)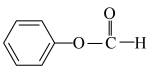 与E互为
与E互为___________ (填字母)。
a.同位素 b.同素异形体 c.同系物 d.同分异构体

回答下列问题:
(1)A的分子式为
(2)上述五种有机物属于
a.芳香烃 b.脂环化合物 c.芳香族化合物 d.脂肪烃衍生物
(3)A一溴代物有
(4)C中碳原子杂化类型是
(5)C、D的沸点依次为204.7℃、179℃,二者沸点差异的主要原因是
(6)
 与E互为
与E互为a.同位素 b.同素异形体 c.同系物 d.同分异构体
您最近一年使用:0次
解题方法
6 . 草木灰是农家肥料,它的主要成分是碳酸钾,还含有硫酸钾、氯化钾等,下列说法正确的是
A.键角: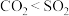 |
| B.氯化钾中含有共价键 |
C. 与 与 的中心原子杂化轨道类型相同 的中心原子杂化轨道类型相同 |
D.等物质的量的 和 和 ,二者的价电子总数相同 ,二者的价电子总数相同 |
您最近一年使用:0次
7 . 硼及其化合物在制造、化工等领域都有广泛应用,回答下列问题:
(1)基态硼原子的价电子排布图为__________ ,其占据最高能级电子的电子云轮廓图形状为__________ ,基态硼原子比基态氮原子的第一电离能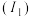 小,其原因为
小,其原因为__________ 。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:
① 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为__________ 。
② 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为__________ 。
③ 的键角为
的键角为__________ 。
(3)写出B与 溶液反应的离子方程式:
溶液反应的离子方程式:__________ 。
(4) 为一元弱酸[常温下,
为一元弱酸[常温下,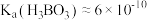 ]:
]:
① 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为__________ 。
②常温下, 的硼酸的pH约为
的硼酸的pH约为__________ (已知: ,
, )。
)。
(1)基态硼原子的价电子排布图为
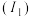 小,其原因为
小,其原因为(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:①
 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为②
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为③
 的键角为
的键角为(3)写出B与
 溶液反应的离子方程式:
溶液反应的离子方程式:(4)
 为一元弱酸[常温下,
为一元弱酸[常温下,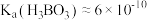 ]:
]:①
 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为②常温下,
 的硼酸的pH约为
的硼酸的pH约为 ,
, )。
)。
您最近一年使用:0次
2024-03-07更新
|
127次组卷
|
2卷引用:河北省邢台市四校联盟2023-2024学年高二上学期11月月考化学试题
名校
解题方法
8 . 传世名画之一的《千里江山图》中青绿山水用“绿青”[主要成分为CuCO3⋅Cu(OH)2]等矿物颜料绘制而成。下列有关说法正确的是
| A.氧元素位于元素周期表的s区 |
B. 中C原子的杂化方式为sp3 中C原子的杂化方式为sp3 |
| C.H、C、O三种元素的电负性由大到小的顺序:O>C>H |
D.“绿青”与盐酸反应的化学方程式为 |
您最近一年使用:0次
2024-03-07更新
|
232次组卷
|
3卷引用:河北省部分重点高中2023-2024学年高三上学期2月期末化学试题
名校
9 . 过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是___________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是___________ ,中心离子的配位数为___________ 。
(3) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。 中P的杂化类型是
中P的杂化类型是___________ 。 的沸点比
的沸点比 的
的___________ 。(填“高”或“低”或“相同”)
 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(3)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。 中P的杂化类型是
中P的杂化类型是 的沸点比
的沸点比 的
的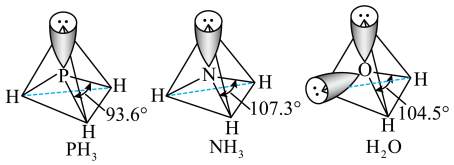
您最近一年使用:0次
2024-03-05更新
|
223次组卷
|
2卷引用:河北省沧州市吴桥县吴桥中学2023-2024学年高二下学期3月月考化学试题
10 . 已知A、B、D、E、G、X、Y、Z八种元素的原子序数依次增大。其中,A原子核外电子只有1种运动状态;基态B、E原子的2p轨道均含2个未成对电子;G是周期表中电负性最大的元素;Y和G同主族,X和Y同周期,且X离子是同周期元素简单离子中半径最小的;Z是八种元素中唯一的第四周期元素位于ds区,且基态原子核外只有1个未成对电子其余均为成对电子。推断出元素符号及相应化学式,并回答下列问题:
(1)基态Z原子的简化核外电子排布式:_______ ,基态E原子价层电子轨道表达式:_______ ,基态X原子的核外电子排布共有_______ 个能级。
(2)键能:G-G_______ Y-Y(填“>或<”,后同);B和D的第三电离能:B_______ D。
(3)A2E分子的VSEPR理想模型为_______ ;已知DA3溶于A2E溶液呈碱性,试在方框内画出DA3与A2E的分子间形成的氢键_______ 。

(4)B2A2分子中σ键和π键的比例_______ ;B2A2、E2在NaOH溶液中可构建燃料电池,试写出该燃料电池负极的电极反应式:_______ 。
(1)基态Z原子的简化核外电子排布式:
(2)键能:G-G
(3)A2E分子的VSEPR理想模型为

(4)B2A2分子中σ键和π键的比例
您最近一年使用:0次



