名校
解题方法
1 . La、Cu、O组成复合氧化物是超导体基体材料,可以做光催化分解水的电极材料,对制备绿色无污染的氢能源意义重大。回答下列问题:
(1)基态Cu原子核外电子排布式为___ 。
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
计算5f能级的值为___ 。
(3)已知铜的某些化合物的熔点:
则CuSe为___ 晶体,CuSe的熔点大于CuS的熔点的原因是___ 。
(4)一种Cu2+的配合离子结构简式为: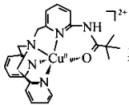 其中,N原子的杂化方式为
其中,N原子的杂化方式为___ ,Cu2+的配位数为___ 。
(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为___ (任写一种)。
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为___ 。
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为___ g·cm-3。
(1)基态Cu原子核外电子排布式为
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
| I | 0 | 1 | 2 | 3 |
| 亚层符号 | s | p | d | f |
计算5f能级的值为
(3)已知铜的某些化合物的熔点:
| CuO | CuS | CuSe | |
| 熔点(℃) | 1326 | 103 | 387 |
则CuSe为
(4)一种Cu2+的配合离子结构简式为:
 其中,N原子的杂化方式为
其中,N原子的杂化方式为(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为
您最近一年使用:0次
2021-09-10更新
|
107次组卷
|
2卷引用:河北省石家庄市第二中学2022届高三10月第三次考试化学试卷
解题方法
2 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(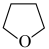 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: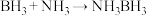 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
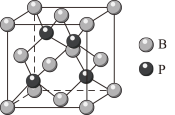
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: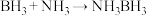 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
名校
解题方法
3 . 自然界中不存在氟的单质,得到单质氟的过程中,不少科学家为此献出了宝费的生命。1886年,法国化学家莫瓦桑发明了莫氏电炉,用电解法成功地制取了单质氟,因此荣获1906年诺贝尔化学奖,氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(1)氟磷灰石可用于制取磷肥,基态P原子有_______ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为_______ 。
(2)氟气可以用于制取情性强于N2的保护气SF6,也可以用于制取聚合反应的催化剂PF3,PF3可以作为工业制取硅单质的中间物质(SiF4)的原料。
①SiF4分子的空间结构为_______ 。
②S、P、Si的第一电离能由大到小的顺序为_______ 。
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯(C2F4),50g四氟乙烯含σ键的数目为_______ 。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3AlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为_______ ,工业上不用电解AlCl3制取铝的原因为_______ 。
(1)氟磷灰石可用于制取磷肥,基态P原子有
 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取情性强于N2的保护气SF6,也可以用于制取聚合反应的催化剂PF3,PF3可以作为工业制取硅单质的中间物质(SiF4)的原料。
①SiF4分子的空间结构为
②S、P、Si的第一电离能由大到小的顺序为
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯(C2F4),50g四氟乙烯含σ键的数目为
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3AlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为
您最近一年使用:0次
2024-01-11更新
|
87次组卷
|
3卷引用:河北省石家庄市第二十四中学2023-2024学年高二上学期12月月考化学试题
4 . C、N、O、Si、P、Ge、As及其化合物在科研和生产中有许多重要用途。下列相关叙述正确的是


| A.基态氮原子核外电子占据的原子轨道数目为5 |
B.图1表示碳、硅和磷三种元素的四级电离能变化趋势,其中表示磷的曲线是 |
C. 的分子结构如图2所示,则在该化合物中 的分子结构如图2所示,则在该化合物中 的杂化方式是 的杂化方式是 |
D. 的稳定性比 的稳定性比 高,原因是 高,原因是 键能大于 键能大于 键能 键能 |
您最近一年使用:0次
名校
解题方法
5 . 钴的化合物在工业中有重要用途。请回答下列问题:
(1) 中配体NH3为
中配体NH3为___________ (填“极性”或“非极性”)分子,NH3分子中N-H键的键角___________ (填“>”、“<”或“=”) 中N-H键的键角,原因为
中N-H键的键角,原因为___________ 。
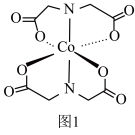
(2)Co的一种配合物结构如图1,其配位数为___________ ,C、N、O的第一电离能由大到小的顺序为___________ (填元素符号),其中C原子的杂化方式为___________ 。 )的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。
)的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。___________ 。
②与O原子最近且等距离的O原子有___________ 个。
③该晶体的密度为___________ g·cm-3。
(1)
 中配体NH3为
中配体NH3为 中N-H键的键角,原因为
中N-H键的键角,原因为(2)Co的一种配合物结构如图1,其配位数为
 )的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。
)的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。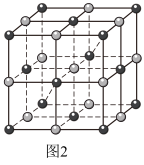
②与O原子最近且等距离的O原子有
③该晶体的密度为
您最近一年使用:0次
2023-10-27更新
|
236次组卷
|
4卷引用:河北省邢台市五岳联盟2023-2024学年高三上学期10月期中考试化学试题
6 . 水合肼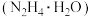 是一种用途广泛的化工原料,是具有较强还原性的碱性液体,在空气中会与
是一种用途广泛的化工原料,是具有较强还原性的碱性液体,在空气中会与 反应产生烟雾。制备
反应产生烟雾。制备 的实验流程如下图所示:
的实验流程如下图所示:

回答下列问题:
Ⅰ.步骤Ⅰ制备 的装置如图1所示。
的装置如图1所示。

已知:①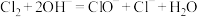 是放热反应;
是放热反应;
② 。
。
(1)装置D中盛装的试剂是_______ ,通入空气的作用是_______ 。若通入的空气没有经过装置A处理的不利影响是_______ 。
(2)为了提高 的产率,防止副反应发生,装置E需要采用冰水浴,实验中除控制温度外还需采取的措施是
的产率,防止副反应发生,装置E需要采用冰水浴,实验中除控制温度外还需采取的措施是_______ 。
Ⅱ.由步骤Ⅱ和步骤Ⅲ获得 的装置如图2所示,利用
的装置如图2所示,利用 与的
与的 溶液在三颈烧瓶中合成
溶液在三颈烧瓶中合成 ,再通过减压蒸馏在锥形瓶H中收集。
,再通过减压蒸馏在锥形瓶H中收集。

(3) 的C、N原子杂化方式分别为
的C、N原子杂化方式分别为_______ 、_______ 。
(4)仪器d的名称为_______ ,干燥管e中盛装的试剂为_______ ,实验中通过仪器c缓慢滴加的溶液是_______ (填“尿素溶液”或“ 溶液”),原因是
溶液”),原因是_______ 。
(5)三颈烧瓶中合成 的化学方程式是
的化学方程式是_______ 。
(6)产品水合肼含量的测定:称取样品液体 ,加入适量
,加入适量 固体,配成溶液,滴入几滴淀粉溶液,用
固体,配成溶液,滴入几滴淀粉溶液,用 的标准
的标准 溶液滴定。实验测得消耗标准
溶液滴定。实验测得消耗标准 溶液的体积为
溶液的体积为 ,则样品中
,则样品中 的质量分数为
的质量分数为_______ (已知: 。
。
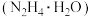 是一种用途广泛的化工原料,是具有较强还原性的碱性液体,在空气中会与
是一种用途广泛的化工原料,是具有较强还原性的碱性液体,在空气中会与 反应产生烟雾。制备
反应产生烟雾。制备 的实验流程如下图所示:
的实验流程如下图所示:
回答下列问题:
Ⅰ.步骤Ⅰ制备
 的装置如图1所示。
的装置如图1所示。
已知:①
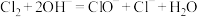 是放热反应;
是放热反应;②
 。
。(1)装置D中盛装的试剂是
(2)为了提高
 的产率,防止副反应发生,装置E需要采用冰水浴,实验中除控制温度外还需采取的措施是
的产率,防止副反应发生,装置E需要采用冰水浴,实验中除控制温度外还需采取的措施是Ⅱ.由步骤Ⅱ和步骤Ⅲ获得
 的装置如图2所示,利用
的装置如图2所示,利用 与的
与的 溶液在三颈烧瓶中合成
溶液在三颈烧瓶中合成 ,再通过减压蒸馏在锥形瓶H中收集。
,再通过减压蒸馏在锥形瓶H中收集。
(3)
 的C、N原子杂化方式分别为
的C、N原子杂化方式分别为(4)仪器d的名称为
 溶液”),原因是
溶液”),原因是(5)三颈烧瓶中合成
 的化学方程式是
的化学方程式是(6)产品水合肼含量的测定:称取样品液体
 ,加入适量
,加入适量 固体,配成溶液,滴入几滴淀粉溶液,用
固体,配成溶液,滴入几滴淀粉溶液,用 的标准
的标准 溶液滴定。实验测得消耗标准
溶液滴定。实验测得消耗标准 溶液的体积为
溶液的体积为 ,则样品中
,则样品中 的质量分数为
的质量分数为 。
。
您最近一年使用:0次
名校
解题方法
7 . Ⅰ、由CO2、甲醇为原料合成绿色化学品碳酸二甲酯(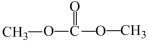 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
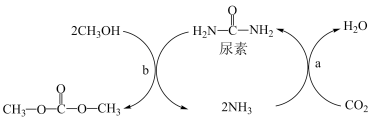
(1)下列说法不正确的是___________ (填字母)。
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
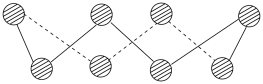
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是___________ 。
(3) 的电子式是
的电子式是___________ ,依据 理论推测
理论推测 的空间构型为
的空间构型为___________ ,常温下 是气体而
是气体而 是液体的原因是
是液体的原因是___________ 。
(4) 的键角
的键角___________  的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是___________ 。
(5) 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
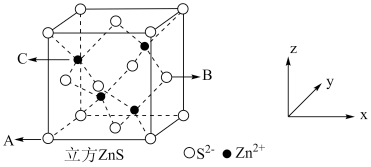
①已知A、B点的原子坐标分别为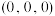 和
和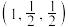 ,则C点的原子坐标为
,则C点的原子坐标为___________ ;
②若晶胞棱长为 ,密度为
,密度为___________  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
(1)下列说法不正确的是
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)
 的电子式是
的电子式是 理论推测
理论推测 的空间构型为
的空间构型为 是气体而
是气体而 是液体的原因是
是液体的原因是(4)
 的键角
的键角 的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是(5)
 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
①已知A、B点的原子坐标分别为
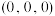 和
和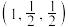 ,则C点的原子坐标为
,则C点的原子坐标为②若晶胞棱长为
 ,密度为
,密度为 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
2022-09-05更新
|
351次组卷
|
6卷引用:河北省昌黎第一中学2023届高三下学期第五次调研考试化学试题
名校
解题方法
8 . NH3与甲醛CH2O反应可以制备乌洛托品(六亚甲基四胺,分子结构为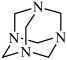 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
(1)基态氮原子的价电子轨道表达式为___________ ,第三电离能I3(C)___________ I3(N)(填“>”或“<)。
(2)NH3的空间构型为___________ ,CH2O中C采取的杂化类型为___________ 。CH2O中碳氢键与NH3中氮氢键相比,键长较长的是___________ 。
(3)乌洛托品为___________ (填“极性”或“非极性”)分子,分子中的所有N原子呈正四面体分布,所有C原子呈___________ 几何体分布,该分子可与H+形成配位键,电子对给予体为___________ 原子。
(4)在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为___________ 。乌洛托品比金刚烷(C10H16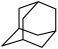 )水溶性更高,理由是
)水溶性更高,理由是___________ 。
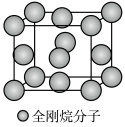
(5)金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3,阿伏加德罗常数为L×1023mol-1,则晶体的密度为___________ g/cm3。
 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:(1)基态氮原子的价电子轨道表达式为
(2)NH3的空间构型为
(3)乌洛托品为
(4)在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为
 )水溶性更高,理由是
)水溶性更高,理由是(5)金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3,阿伏加德罗常数为L×1023mol-1,则晶体的密度为

您最近一年使用:0次
2022-03-27更新
|
625次组卷
|
5卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)(结构与性质)
(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(结构与性质)四川省南充市2022届高三 适应性考试(二模)理综化学试题贵州省贵阳市五校2021-2022学年高三下学期联考理科综合化学试题(七)湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题
名校
9 . 由于钒的化合物颜色鲜艳而多彩,因此以神话中斯堪的纳维亚女神“Vanadis"的名字命名。钒有多种化合价,如:+2、+3、+4、+5等,其化合物具有广泛的用途。请回答下列问题:
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ ,表示,与之相反的用 -
,表示,与之相反的用 - 表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为
表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为___________ 。
(2)钒的一种配合物的结构简式为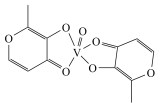 ,该配合物的组成元素的电负性由大到小的顺序是
,该配合物的组成元素的电负性由大到小的顺序是_______ (用元素符号表示),氧原子的杂化轨道类型为__________ ,该配合物分子中含有的化学键类型有________ (填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键
(3)钒的含氧酸有正钒酸(H3VO4)、偏钒酸(HVO3)等,正钒酸、偏钒酸的酸性由强到弱的顺序是_____________ (用分子式表示),原因为________ 。
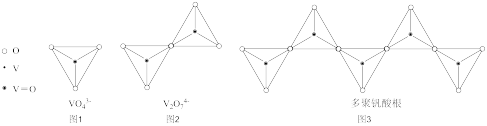
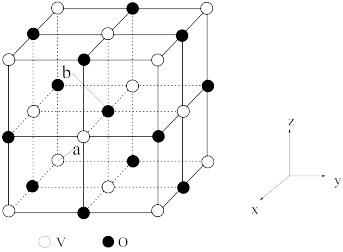
(4)钒的多种含氧酸根离子的结构如图所示,图3为一种无限长单链结构的多聚钒酸根,其化学式为__ 。
(5)钒的某种氧化物的立方晶胞如图所示,该氧化物的化学式为________________________ ;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,若a点原子的分数坐标为(0,0,0),则b点原子的分数坐标为____________________ ;钒原子构成的八面体空隙与氧原子构成的八 面体空隙的数量比为_________________________ ;已知该氧化物晶体的密度为ρg·cm-3。则晶胞中距离最近的两个氧原子的核间距为_________________ pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 ,表示,与之相反的用 -
,表示,与之相反的用 - 表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为
表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为(2)钒的一种配合物的结构简式为
 ,该配合物的组成元素的电负性由大到小的顺序是
,该配合物的组成元素的电负性由大到小的顺序是A.离子键 B.极性键 C.非极性键 D.配位键
(3)钒的含氧酸有正钒酸(H3VO4)、偏钒酸(HVO3)等,正钒酸、偏钒酸的酸性由强到弱的顺序是
(4)钒的多种含氧酸根离子的结构如图所示,图3为一种无限长单链结构的多聚钒酸根,其化学式为

(5)钒的某种氧化物的立方晶胞如图所示,该氧化物的化学式为

您最近一年使用:0次
21-22高三上·河北·阶段练习
名校
解题方法
10 . 镍及其化合物用途广泛,可用作催化剂、合金、电器元件等。回答下列问题:
(1)基态Ni原子价电子的轨道表示式为___________ 。
(2)某镍配合物由1个 与2个
与2个 离子组成。
离子组成。
①组成该镍配合物的元素中,第二周期元素的第一电离能由高到低的顺序为___________ (用元素符号表示,下同),配合物中采用 杂化的原子为
杂化的原子为___________ 。
②已知该配合物中只有一种元素的原子与 配位,则与镍配位的原子为
配位,则与镍配位的原子为___________ (填“C”“N”或“O”),原因为___________ 。
(3)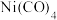 是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于
是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于 、苯等有机溶剂的原因为
、苯等有机溶剂的原因为___________ ,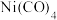 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为___________ ;与配合物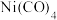 中配体互为等电子体的阴离子为
中配体互为等电子体的阴离子为___________ (任写一种)。
(4)由Mg、C和Ni组成的新型超导材料晶体的立方晶胞结构如图所示:

①该新型超导材料的化学式为___________ 。
②若晶胞参数为a nm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为___________  。
。
(1)基态Ni原子价电子的轨道表示式为
(2)某镍配合物由1个
 与2个
与2个 离子组成。
离子组成。①组成该镍配合物的元素中,第二周期元素的第一电离能由高到低的顺序为
 杂化的原子为
杂化的原子为②已知该配合物中只有一种元素的原子与
 配位,则与镍配位的原子为
配位,则与镍配位的原子为(3)
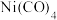 是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于
是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于 、苯等有机溶剂的原因为
、苯等有机溶剂的原因为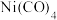 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为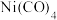 中配体互为等电子体的阴离子为
中配体互为等电子体的阴离子为(4)由Mg、C和Ni组成的新型超导材料晶体的立方晶胞结构如图所示:

①该新型超导材料的化学式为
②若晶胞参数为a nm,阿伏加德罗常数的值为
 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次
2021-09-28更新
|
672次组卷
|
3卷引用:河北省神州智达省级联测2022届高三上学期第二次考试化学试题



