名校
解题方法
1 . 氮、磷、砷等元素的单质及其化合物在生产生活中应用广泛。回答下列问题:
(1) 是一种优良的等离子蚀刻气体,在芯片制造、高能激光器方面有广泛应用,
是一种优良的等离子蚀刻气体,在芯片制造、高能激光器方面有广泛应用, 分子的空间构型为
分子的空间构型为________ 。
(2)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与_______ 个氮原子相连,氮化铝晶体属于__________ 晶体。
(3)石墨相氮化碳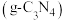 作为一种新型光催化材料,研究表明,非金属掺杂(
作为一种新型光催化材料,研究表明,非金属掺杂( 等)能提高其光催化活性。
等)能提高其光催化活性。 具有和石墨相似的层状结构,其中一种二维平面结构如图所示。下列说法
具有和石墨相似的层状结构,其中一种二维平面结构如图所示。下列说法不正确 的是 。
(4) 是一种重要的半导体材料,晶胞结构如图1;将
是一种重要的半导体材料,晶胞结构如图1;将 掺杂到
掺杂到 的晶体中得到稀磁性半导体材料,如图2。
的晶体中得到稀磁性半导体材料,如图2。 ,则B原子的分数坐标为
,则B原子的分数坐标为_______ ;若 晶体密度为
晶体密度为 ,设
,设 为阿伏加德罗常数的值,则晶胞中两个
为阿伏加德罗常数的值,则晶胞中两个 原子间的最小距离为
原子间的最小距离为_________  (列出计算式即可);稀磁性半导体材料中
(列出计算式即可);稀磁性半导体材料中 的原子个数比为
的原子个数比为_________ 。
(1)
 是一种优良的等离子蚀刻气体,在芯片制造、高能激光器方面有广泛应用,
是一种优良的等离子蚀刻气体,在芯片制造、高能激光器方面有广泛应用, 分子的空间构型为
分子的空间构型为(2)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与
(3)石墨相氮化碳
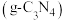 作为一种新型光催化材料,研究表明,非金属掺杂(
作为一种新型光催化材料,研究表明,非金属掺杂( 等)能提高其光催化活性。
等)能提高其光催化活性。 具有和石墨相似的层状结构,其中一种二维平面结构如图所示。下列说法
具有和石墨相似的层状结构,其中一种二维平面结构如图所示。下列说法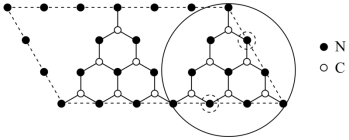
| A.基态C原子的成对电子数与未成对电子数之比为2∶1 |
B.1mol  晶体中含有C-N键的数目为4.5NA 晶体中含有C-N键的数目为4.5NA |
C. 原子的配位数为2和3 原子的配位数为2和3 |
D. 晶体中存在的微粒间作用力有共价键和范德华力 晶体中存在的微粒间作用力有共价键和范德华力 |
 是一种重要的半导体材料,晶胞结构如图1;将
是一种重要的半导体材料,晶胞结构如图1;将 掺杂到
掺杂到 的晶体中得到稀磁性半导体材料,如图2。
的晶体中得到稀磁性半导体材料,如图2。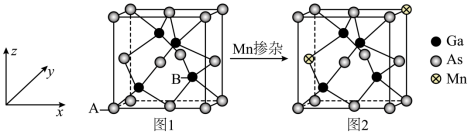
 ,则B原子的分数坐标为
,则B原子的分数坐标为 晶体密度为
晶体密度为 ,设
,设 为阿伏加德罗常数的值,则晶胞中两个
为阿伏加德罗常数的值,则晶胞中两个 原子间的最小距离为
原子间的最小距离为 (列出计算式即可);稀磁性半导体材料中
(列出计算式即可);稀磁性半导体材料中 的原子个数比为
的原子个数比为
您最近一年使用:0次
名校
解题方法
2 . 锂是最轻的固体金属,锂及其化合物在有机合成、电池等领域应用广泛。回答下列问题:
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中氢元素的化合价为___________ 。
(2)12-冠-4(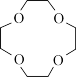 )可与锂离子络合,其中氧的杂化方式为
)可与锂离子络合,其中氧的杂化方式为_______ 。
(3)锂钴复合氧化物是目前常用锂离子电池的正极材料,其理想结构如图所示。___________ 。
②该理想结构可分割为___________ 个晶胞。
③锂钴复合氧化物的化学式为___________ ,已知该理想结构的晶胞边长为分别为anm和cnm,该晶体的密度为________ g•cm-3(用含a、c以及NA的计算式表达,NA为阿伏加德罗常数的值)。
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中氢元素的化合价为
(2)12-冠-4(
 )可与锂离子络合,其中氧的杂化方式为
)可与锂离子络合,其中氧的杂化方式为(3)锂钴复合氧化物是目前常用锂离子电池的正极材料,其理想结构如图所示。
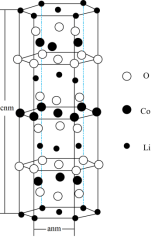
②该理想结构可分割为
③锂钴复合氧化物的化学式为
您最近一年使用:0次
名校
3 . 按照要求填空:
(1)判断下列分子的极性、分子的空间构型和中心原子的杂化方式。
(2)① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ 。
。
①既有 键,又有
键,又有 键的是
键的是_______ (用序号作答);既含有极性键又含有非极性键的极性分子的电子式为_______ ;既含有极性键又含有非极性键的非极性分子中碳原子的杂化方式为________ ;苯环中存在的大 键可表示为
键可表示为________ 。
②属于离子化合物的物质的电子式为______ ; 与
与 结构相似,则
结构相似,则 的电子式为
的电子式为_____ ; 中
中 键和
键和 键之比为
键之比为______ 。
(1)判断下列分子的极性、分子的空间构型和中心原子的杂化方式。
| 序号 | 化学式 | 分子的极性 | 空间构型 | 中心原子的杂化方式 |
| ① |  | |||
| ② |  | |||
| ③ |  | - |
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ 。
。①既有
 键,又有
键,又有 键的是
键的是 键可表示为
键可表示为②属于离子化合物的物质的电子式为
 与
与 结构相似,则
结构相似,则 的电子式为
的电子式为 中
中 键和
键和 键之比为
键之比为
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.已知A、B、C、D、E为原子序数依次增大的短周期主族元素。其中A元素的一种同位素中没有中子,B元素原子的L层电子数是K层电子数的2倍,D元素是地壳中含他最多的元素,E的原子序数是A、C原子序数之和的2倍。回答下列问题:
(1)B元素在周期表中的位置是___________ ;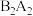 是由极性键和非极性键形成的
是由极性键和非极性键形成的___________ (填“极性”或“非极性”)分子。
(2)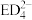 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为___________ ,VSEPR模型名称为___________ 。
(3)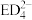 、
、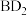 和
和 的键角由大到小的顺序是
的键角由大到小的顺序是___________ (用化学式表示)。
Ⅱ.研究发现,在低压合成甲醇反应(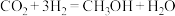 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(4)在 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为___________ 。
(5)1mol丙酮(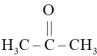 )分子中含有
)分子中含有 键的数目为
键的数目为___________ 。(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
(6)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝的晶体类型是___________ 。
(1)B元素在周期表中的位置是
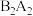 是由极性键和非极性键形成的
是由极性键和非极性键形成的(2)
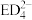 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为(3)
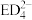 、
、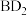 和
和 的键角由大到小的顺序是
的键角由大到小的顺序是Ⅱ.研究发现,在低压合成甲醇反应(
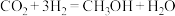 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:(4)在
 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为(5)1mol丙酮(
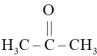 )分子中含有
)分子中含有 键的数目为
键的数目为 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)(6)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝的晶体类型是
您最近一年使用:0次
名校
解题方法
5 . 下列每组微粒的中心原子杂化方式和空间构型均相同的是
A. 、 、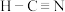 | B. 、 、 |
C. 、 、 | D. 、 、 |
您最近一年使用:0次
名校
解题方法
6 . 味精能增加食品的鲜味,是一种常用的增味剂,其化学名称为谷氢酸钠(结构如图所示),下列有关谷氨酸钠的说法正确的是

| A.所有原子均满足8电子结构 |
B.该物质中碳原子的杂化类型有sp、 和 和 |
| C.该物质中含有2个手性碳原子 |
| D.该物质既可形成分子间氢键又可形成分子内氢键 |
您最近一年使用:0次
名校
解题方法
7 . 类推的思维方法在化学学习中应用广泛,但类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论错误的是
| A.Al(OH)3能与NaOH溶液反应,则Be(OH)2也能与NaOH溶液反应 |
| B.SO2是“V形”分子,则O3是“V形”分子 |
| C.NH3中N原子采用sp3杂化则PH3中P也采用sp3杂化 |
| D.工业制Mg采用电解熔融MgCl2的方法,则工业制Al也可采用电解熔融AlCl3的方法 |
您最近一年使用:0次
2024-04-11更新
|
117次组卷
|
2卷引用:宁夏六盘山高级中学2023-2024学年高二下学期第一次月考化学试题
名校
8 . 硫酰氟SO2F2是一种低温高效杀虫剂,分子呈四面体型,结构如图所示。下列有关说法不正确的是

| A.硫原子的杂化方式是sp3 |
| B.SO2F2是极性分子 |
| C.键角大小:α>β |
| D.SO2F2分子结构中心对称,不是手性分子 |
您最近一年使用:0次
2024-01-25更新
|
137次组卷
|
3卷引用:宁夏吴忠市吴忠中学2023-2024学年高二下学期第一次月考化学试卷
名校
解题方法
9 . 下列说法正确的是
①甲醛中碳的杂化方式为sp 2
②若R2-和M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔、沸点随相对分子质量的增大而升高
④由于非金属性:Cl>Br>I,所以酸性:HCl>HBr>HI
⑤氨的液化会破坏共价键
⑥C与H形成的化合物中只存在极性共价键
⑦Na2O2固体中的阴离子和阳离子个数比是1∶2
①甲醛中碳的杂化方式为sp 2
②若R2-和M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔、沸点随相对分子质量的增大而升高
④由于非金属性:Cl>Br>I,所以酸性:HCl>HBr>HI
⑤氨的液化会破坏共价键
⑥C与H形成的化合物中只存在极性共价键
⑦Na2O2固体中的阴离子和阳离子个数比是1∶2
| A.②⑤⑥ | B.③⑤⑦ | C.②④⑤ | D.①③⑦ |
您最近一年使用:0次
2023-10-24更新
|
176次组卷
|
2卷引用:宁夏石嘴山市平罗中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
10 . 回答下列问题
(1)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。
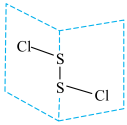
①S2Cl2的结构式为___________ , 的化学键类型为
的化学键类型为___________ (填“极性键”、“非极性键”或“极性键和非极性键”),它是___________ (填“极性”或“非极性”)分子。
②电负性:S___________ Cl (填“>”或“<”), 中硫的化合价为
中硫的化合价为___________ 。
③S2Cl2分子中S原子的杂化轨道类型为___________ ,每个S原子有 ___________ 对孤电子对。
(2)毒奶粉中发现的化工原料三聚氰胺可以由下列反应合成:CaO+3C CaC2+CO↑;CaC2+N2
CaC2+CO↑;CaC2+N2 CaCN2+C;
CaCN2+C; ;
;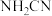 与水反应生成尿素
与水反应生成尿素 ;尿素合成三聚氰胺。
;尿素合成三聚氰胺。
①基态钙原子电子占据的最高能级符号是___________ ,其核外共有___________ 种不同能量的电子。
② 中阴离子为
中阴离子为 ,
, 与CO2分子空间结构相似,由此可以推知
与CO2分子空间结构相似,由此可以推知 的空间结构为
的空间结构为___________ 。
③尿素分子 中所含元素的电负性由大到小的顺序为
中所含元素的电负性由大到小的顺序为___________ 。
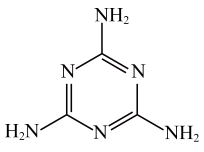
④三聚氰胺俗称“蛋白精”,其结构如图,其中氮原子的杂化方式为___________ 。
(1)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。

①S2Cl2的结构式为
 的化学键类型为
的化学键类型为②电负性:S
 中硫的化合价为
中硫的化合价为③S2Cl2分子中S原子的杂化轨道类型为
(2)毒奶粉中发现的化工原料三聚氰胺可以由下列反应合成:CaO+3C
 CaC2+CO↑;CaC2+N2
CaC2+CO↑;CaC2+N2 CaCN2+C;
CaCN2+C; ;
;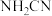 与水反应生成尿素
与水反应生成尿素 ;尿素合成三聚氰胺。
;尿素合成三聚氰胺。①基态钙原子电子占据的最高能级符号是
②
 中阴离子为
中阴离子为 ,
, 与CO2分子空间结构相似,由此可以推知
与CO2分子空间结构相似,由此可以推知 的空间结构为
的空间结构为③尿素分子
 中所含元素的电负性由大到小的顺序为
中所含元素的电负性由大到小的顺序为④三聚氰胺俗称“蛋白精”,其结构如图,其中氮原子的杂化方式为

您最近一年使用:0次



