解题方法
1 . 硅及其化合物在生活、生产和科技等方面应用广泛。工业制备高纯硅的主要过程如下:
石英砂(主要成分 )
)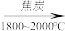 粗硅
粗硅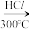

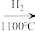 高纯硅
高纯硅
(1) 位于元素周期表第
位于元素周期表第_____ 周期,第_____ 族。
(2)由硅原子核形成的三种微粒,电子排布式分别为:a.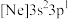 、b.
、b.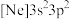 、c.
、c.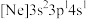 ,有关这些微粒的叙述,正确的是_____(填标号)。
,有关这些微粒的叙述,正确的是_____(填标号)。
(3)石英砂与焦炭反应制备粗硅的化学方程式为_____ 。粗硅与 反应过程中会有副产物
反应过程中会有副产物 生成,
生成, 中
中 的杂化轨道类型为
的杂化轨道类型为_____ 。 的键角
的键角_____ (填“大于”、“小于”或“等于”) 的键角。
的键角。
(4) 以空间结构为
以空间结构为_____ 。 和
和 会剧烈反应,写出该反应的化学方程式
会剧烈反应,写出该反应的化学方程式_____ (已知:电负性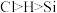 )。
)。
石英砂(主要成分
 )
) 粗硅
粗硅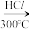

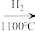 高纯硅
高纯硅(1)
 位于元素周期表第
位于元素周期表第(2)由硅原子核形成的三种微粒,电子排布式分别为:a.
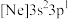 、b.
、b.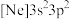 、c.
、c.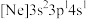 ,有关这些微粒的叙述,正确的是_____(填标号)。
,有关这些微粒的叙述,正确的是_____(填标号)。A.微粒半径: |
| B.电子排布属于基态原子(或离子)的是:a、b |
C.电离一个电子所需最低能量: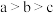 |
D.得电子能力: |
 反应过程中会有副产物
反应过程中会有副产物 生成,
生成, 中
中 的杂化轨道类型为
的杂化轨道类型为 的键角
的键角 的键角。
的键角。(4)
 以空间结构为
以空间结构为 和
和 会剧烈反应,写出该反应的化学方程式
会剧烈反应,写出该反应的化学方程式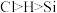 )。
)。
您最近一年使用:0次
2024-04-29更新
|
40次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
2 . 联氨(又称肼,N2H4无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子是___________ 分子(填“极性”或“非极性”),其中氮的杂化方式为___________ 。
(2)①2O2(g)+N2(g)=N2O4(1) H1
H1
②N2(g)+2H2(g)=N2H4(1) H2
H2
③O2(g)+2H2(g)=2H2O(g) H3
H3
④2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mo1
上述反应热效应之间的关系式为△H4=___________ ,联氨和N2O4可作为火箭推进剂的主要原因为___________ 。
(3)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________ (已知:N2H4+H+
 的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为___________ 。
(4)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生﹐发生的化学方程式为___________ 。联氨可用于处理高压锅炉水中的氧。防止锅炉被腐蚀。理论上2kg的联氨可除去水中溶解的O2___________ kg。
(1)联氨分子是
(2)①2O2(g)+N2(g)=N2O4(1)
 H1
H1②N2(g)+2H2(g)=N2H4(1)
 H2
H2③O2(g)+2H2(g)=2H2O(g)
 H3
H3④2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mo1
上述反应热效应之间的关系式为△H4=
(3)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为

 的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为(4)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生﹐发生的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 根据要求回答以下问题。
(1)下列铍粒子失去1个电子吸收能量最少的是_____(填标号)。
(2)苯分子中含有大 键,可记为
键,可记为 (右下角
(右下角 表示6个原子,右上角“6"表示6个共用电子)。已知某化合物的结构简式为
表示6个原子,右上角“6"表示6个共用电子)。已知某化合物的结构简式为  ,不能使溴的四氯化碳溶液褪色,该分子中的大
,不能使溴的四氯化碳溶液褪色,该分子中的大 键,可表示为
键,可表示为_______ , 的杂化方式为
的杂化方式为_______ 。
(3)硫酸铜溶于水后形成的水合铜离子的结构式为_______ (写清楚配位键),向硫酸铜溶液中逐滴加入氨水直至过量,观察到的现象为______ 。
(4)FeCl3的沸点(319℃,易升华)高于AsCl3的沸点(130.2℃),原因是_______ 。
(5)PCl5是一种白色晶体,其晶胞如图所示。该晶体熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。

①写出PCl5熔融时的电离方程式_______ 。
②若晶胞参数为anm,则晶体的密度为_______  (列出计算式)。
(列出计算式)。
(1)下列铍粒子失去1个电子吸收能量最少的是_____(填标号)。
A. | B. | C.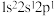 | D.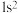 |
(2)苯分子中含有大
 键,可记为
键,可记为 (右下角
(右下角 表示6个原子,右上角“6"表示6个共用电子)。已知某化合物的结构简式为
表示6个原子,右上角“6"表示6个共用电子)。已知某化合物的结构简式为  ,不能使溴的四氯化碳溶液褪色,该分子中的大
,不能使溴的四氯化碳溶液褪色,该分子中的大 键,可表示为
键,可表示为 的杂化方式为
的杂化方式为(3)硫酸铜溶于水后形成的水合铜离子的结构式为
(4)FeCl3的沸点(319℃,易升华)高于AsCl3的沸点(130.2℃),原因是
(5)PCl5是一种白色晶体,其晶胞如图所示。该晶体熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。

①写出PCl5熔融时的电离方程式
②若晶胞参数为anm,则晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
4 . 将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
(1)酞菁和钴酞菁的分子结构如图所示。酞菁分子中所有原子共平面,其中P轨道能提供一对电子的N原子是___________ (填图1酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为___________ ,氮原子提供孤对电子与钴离子形成___________ 键。

(2)①气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为___________ 。
②AlF3的熔点为1090℃,远高于AlCl3的192℃,原因为___________ 。
③AlF3结构属立方晶系,晶胞如图3b所示,F-的配位数为___________ 。若晶胞参数为apm,晶体密度ρ=___________ g/cm3(列出计算式,阿伏加德罗常数的值为NA)。

(3)如图,在NaCl的晶体中,Na+和Cl-互相占据对方的正八面体空隙,CaF2晶体中,F-占据由Ca2+构成的所有正四面体空隙。钛镍合金具有形状记忆功能。某钛、镍原子个数比为2:1的合金的晶体结构为镍原子呈面心立方排列,钛原子填充在由镍原子围成的所有八面体空隙和一半的四面体空隙中,若最近的钛原于和镍原子紧密接触,镍原子周围距离最近的钛原子数为___________ ;钛原子和镍原子的半径分别为r1和r2,该晶体的空间利用率为___________ (用含r的代数式表示,不必化简﹐空间利用率= ×100%)。
×100%)。

(1)酞菁和钴酞菁的分子结构如图所示。酞菁分子中所有原子共平面,其中P轨道能提供一对电子的N原子是

(2)①气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为
②AlF3的熔点为1090℃,远高于AlCl3的192℃,原因为
③AlF3结构属立方晶系,晶胞如图3b所示,F-的配位数为

(3)如图,在NaCl的晶体中,Na+和Cl-互相占据对方的正八面体空隙,CaF2晶体中,F-占据由Ca2+构成的所有正四面体空隙。钛镍合金具有形状记忆功能。某钛、镍原子个数比为2:1的合金的晶体结构为镍原子呈面心立方排列,钛原子填充在由镍原子围成的所有八面体空隙和一半的四面体空隙中,若最近的钛原于和镍原子紧密接触,镍原子周围距离最近的钛原子数为
 ×100%)。
×100%)。
您最近一年使用:0次
名校
解题方法
5 . 碳的多种同素异形体及一系列化合物广泛应用于科研、医疗、工农业生产等领域。钴单质及其化合物在生产、生活中有广泛应用。回答下列问题:
(2) 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中
中 键和
键和 键的数目比为
键的数目比为___________ ,其空间构型为___________ 。
(3)甲醇为溶剂, 可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示),色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为
可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示),色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为___________ (填元素符号),色胺酮分子中N原子的杂化类型有___________ ,X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个 分子,
分子, 通过
通过___________ 作用与色胺酮钴配合物相结合。
(4)金属钴晶体的晶胞呈六棱柱形,其结构如图所示,每个晶胞中含Co原子数为___________ ;晶胞底面呈正六边形,边长为apm,设 为阿伏加德罗常数的值,晶胞的密度
为阿伏加德罗常数的值,晶胞的密度 ,则该晶胞的高b为
,则该晶胞的高b为___________ pm(列出计算式)。

A. | B. | C. | D.苯 |
(2)
 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中
中 键和
键和 键的数目比为
键的数目比为(3)甲醇为溶剂,
 可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示),色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为
可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示),色胺酮分子中所含元素(H、C、N、O)的电负性由大到小的顺序为 分子,
分子, 通过
通过(4)金属钴晶体的晶胞呈六棱柱形,其结构如图所示,每个晶胞中含Co原子数为
 为阿伏加德罗常数的值,晶胞的密度
为阿伏加德罗常数的值,晶胞的密度 ,则该晶胞的高b为
,则该晶胞的高b为 
您最近一年使用:0次
解题方法
6 . 双氯芬酸钠(化合物J)是一种解热镇痛类药物,其一种合成方法如图:
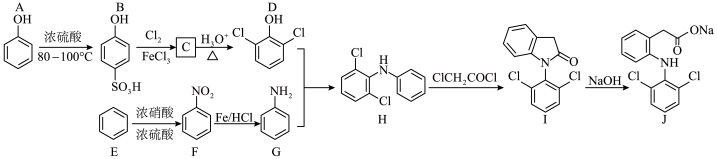
(1)A中所含的官能团名称:___________ ,D的化学名称:___________ 。
(2)C的结构简式:___________ , 的反应类型:
的反应类型:___________ 。
(3)写出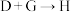 的化学方程式:
的化学方程式:___________ 。
(4)设计 和
和 两步反应的目的是
两步反应的目的是___________ 。
(5)查阅资料可知 的反应机理如下:
的反应机理如下:
①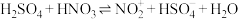
②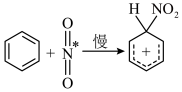
③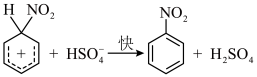
下列说法错误的是___________。
(6)写出同时符合下列条件的1的同分异构体的结构简式___________ (任写1种)
①分子中含有联苯结构(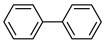 )和
)和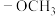 基团
基团
②核磁共振氢谱中只有4组峰

(1)A中所含的官能团名称:
(2)C的结构简式:
 的反应类型:
的反应类型:(3)写出
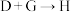 的化学方程式:
的化学方程式:(4)设计
 和
和 两步反应的目的是
两步反应的目的是(5)查阅资料可知
 的反应机理如下:
的反应机理如下:①
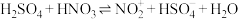
②

③

下列说法错误的是___________。
| A.反应②的活化能比反应③高 | B. 的空间结构为直线形 的空间结构为直线形 |
C.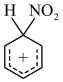 中碳原子均为 中碳原子均为 杂化 杂化 | D.浓硫酸是总反应的催化剂 |
①分子中含有联苯结构(
 )和
)和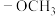 基团
基团②核磁共振氢谱中只有4组峰
您最近一年使用:0次
7 . 臭氧( )在
)在 和
和 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1) 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述)。
(2) 基态核外电子排布式为
基态核外电子排布式为___________ 。
(3)与 分子互为等电子体的一种阴离子为
分子互为等电子体的一种阴离子为___________ (填化学式)。
(4) 分子中
分子中 键与
键与 键的数目比
键的数目比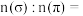
___________ 。
(5) 与
与 反应生成的
反应生成的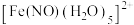 中,
中, 以N原子与
以N原子与 形成配位键。请在
形成配位键。请在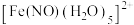 结构示意图的相应位置补填缺少的配体。
结构示意图的相应位置补填缺少的配体。_________

(6)锗的基态原子核外电子排布式为___________ ; 的分子空间构型为
的分子空间构型为___________ 。
 )在
)在 和
和 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(2)
 基态核外电子排布式为
基态核外电子排布式为(3)与
 分子互为等电子体的一种阴离子为
分子互为等电子体的一种阴离子为(4)
 分子中
分子中 键与
键与 键的数目比
键的数目比
(5)
 与
与 反应生成的
反应生成的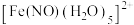 中,
中, 以N原子与
以N原子与 形成配位键。请在
形成配位键。请在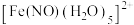 结构示意图的相应位置补填缺少的配体。
结构示意图的相应位置补填缺少的配体。
(6)锗的基态原子核外电子排布式为
 的分子空间构型为
的分子空间构型为
您最近一年使用:0次
名校
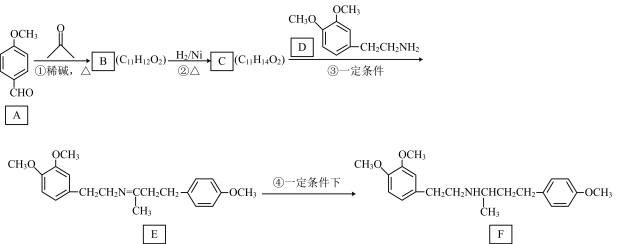
8 . 化合物F是合成盐酸多巴酚丁胺的中间体,其合成路线如下:
已知:①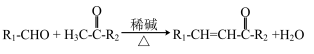
② (
( 、
、 、
、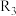 、
、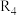 均为烃基)
均为烃基)
回答下列问题:
(1)A中C原子的杂化方式为___________ 。
(2)D中的官能团名称为___________ ,B→C的反应类型为___________ 。
(3)B的结构简式为___________ 。
(4)C+D→E的化学方程式为___________ 。
(5)同时符合下列条件的D的同分异构体有___________ 种(不包括立体异构体),其中核磁共振氢谱的峰面积之比为9:2:2:2的结构简式为___________ (任写一种)。
①可以与氯化铁溶液发生显色反应;
②不含氮氧键;
③只有4种不同化学环境的氢原子。
(6)参照上述流程,设计以 为原料合成
为原料合成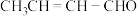 的流程图:
的流程图:______ (无机试剂、有机溶剂任选)。

已知:①

②
 (
( 、
、 、
、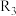 、
、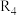 均为烃基)
均为烃基)回答下列问题:
(1)A中C原子的杂化方式为
(2)D中的官能团名称为
(3)B的结构简式为
(4)C+D→E的化学方程式为
(5)同时符合下列条件的D的同分异构体有
①可以与氯化铁溶液发生显色反应;
②不含氮氧键;
③只有4种不同化学环境的氢原子。
(6)参照上述流程,设计以
 为原料合成
为原料合成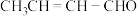 的流程图:
的流程图:
您最近一年使用:0次
2023-04-11更新
|
401次组卷
|
2卷引用:湖北省新高考联考协作体2022-2023学年高三下学期4月月考化学试题
解题方法
9 . 甲醇(CH3OH)是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_______ ,其核外电子共占据_______ 个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_______ ,其组成元素的电负性由小到大的顺序为_______ 。
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为_______ 。
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为_______ 。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为
②甲醇和甲醛中碳原子的杂化方式分别为
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为
您最近一年使用:0次
名校
解题方法
10 . 已知:红磷在氯气中燃烧可以生成两种化合物:PCl3和PCl5,PCl5分子中,P原子的1个3s轨道、3个3p轨道和1个3d轨道发生杂化形成5个sp3d杂化轨道;PCl5分子呈三角双锥形,其结构如图1所示:

(1)N、P是同一族元素,P能形成PCl3、PCl5两种氯化物,而N只能形成一种氯化物NCl3,而不能形成NCl5,原因是_______ 。
(2)下列关于PCl5分子的说法正确的有 _______。
(3)PCl5是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种 正八面体形阴离子,该晶体的晶胞如图2所示,熔体中P﹣Cl的键长只有198nm和206nm两种,这两种离子的化学式为 _______ 。

(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因_______ 。

(1)N、P是同一族元素,P能形成PCl3、PCl5两种氯化物,而N只能形成一种氯化物NCl3,而不能形成NCl5,原因是
(2)下列关于PCl5分子的说法正确的有 _______。
| A.PCl5分子中磷原子没有孤对电子 |
| B.PCl5分子中没有形成π键 |
| C.PCl5分子中所有的Cl﹣P﹣Cl键角都相等 |
| D.SF4分子中S原子也采取sp3d杂化 |

(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因
您最近一年使用:0次



