1 . 党的二十大报告中强调“实现碳达峰碳中和是一场广泛而深刻的经济社会系统性变革”。 的转化和利用是实现碳中和的有效途径。回答下列问题。
的转化和利用是实现碳中和的有效途径。回答下列问题。
I.利用 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
① ,
,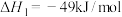
② ,
,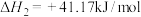
③ ,
,
(1)反应③中
___________ ,若要该反应自发进行,___________ (填“高温”或“低温”)更有利。
(2)在恒温,恒容密闭容器中,对于反应③,下列说法中能说明该反应达到化学平衡状态的是___________(填字母序号)。
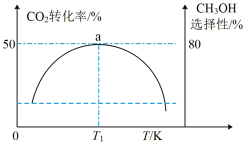
(3)在催化剂作用下,按的 比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时
比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
已知:甲醇的选择性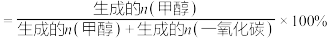
①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是___________ 。
② K时,若反应从开始到达到a点所用时间为5min,
K时,若反应从开始到达到a点所用时间为5min,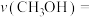
___________  ,反应②的
,反应②的
___________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数 ,最终结果用分数表示)。
,最终结果用分数表示)。
II.
(4)水杨醛缩邻氨基苯酚(A)又被称为“锰试剂”,可与 形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是
形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是___________ (填“A”或“B”),原因是___________ 。
A.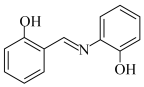 B.
B.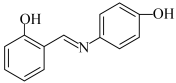
(5)吡啶(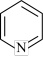 )具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。
)具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。
(6)2001年德国专家从硫酸铵中检出一种组成为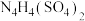 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以 和
和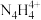 两种离子的形式存在。
两种离子的形式存在。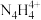 中N原子均为
中N原子均为 杂化,请写出
杂化,请写出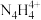 的结构式:
的结构式:___________ 。
 的转化和利用是实现碳中和的有效途径。回答下列问题。
的转化和利用是实现碳中和的有效途径。回答下列问题。I.利用
 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:①
 ,
,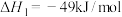
②
 ,
,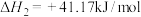
③
 ,
,
(1)反应③中

(2)在恒温,恒容密闭容器中,对于反应③,下列说法中能说明该反应达到化学平衡状态的是___________(填字母序号)。
| A.混合气体的平均相对分子质量不再变化 |
| B.混合气体的密度不再变化 |
C.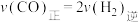 |
D.CO、 、 、 的物质的量之比为1∶2∶1 的物质的量之比为1∶2∶1 |
 比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时
比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
已知:甲醇的选择性
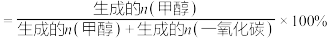
①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是
②
 K时,若反应从开始到达到a点所用时间为5min,
K时,若反应从开始到达到a点所用时间为5min,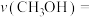
 ,反应②的
,反应②的
 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数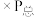 ,最终结果用分数表示)。
,最终结果用分数表示)。II.
(4)水杨醛缩邻氨基苯酚(A)又被称为“锰试剂”,可与
 形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是
形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是A.
 B.
B.
(5)吡啶(
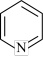 )具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。
)具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。A.吡啶中含有与苯类似的大π键 |
| B.吡啶中N原子的价层孤电子对占据2p轨道 |
C.3-甲基吡啶( )的碱性大于吡啶 )的碱性大于吡啶 |
| D.吡啶在水中的溶解度大于苯在水中的溶解度 |
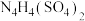 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以 和
和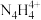 两种离子的形式存在。
两种离子的形式存在。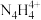 中N原子均为
中N原子均为 杂化,请写出
杂化,请写出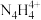 的结构式:
的结构式:
您最近一年使用:0次
2 . 铁元素被称为“人类第一元素”,铁及其化合物具有广泛的应用,回答下列问题。
(1)铁在元素周期表第四周期_______ 族,属于_______ 区元素,基态铁原子M层电子的排布式为_______ 。
(2)铁形成的常见离子有 和
和 ,
, 易被氧化为
易被氧化为 ,请利用核外电子排布的相关原理解释其原因:
,请利用核外电子排布的相关原理解释其原因:_______ 。
(3)检验 是否被氧化为
是否被氧化为 的方法之一是取待测液,加入
的方法之一是取待测液,加入 溶液,观察是否有红色的
溶液,观察是否有红色的 生成。
生成。
① 中
中 的配位数为
的配位数为_______ 。
②配体 中心C原子的杂化方式为:
中心C原子的杂化方式为:_______ 。
③O、N、S三种元素的电负性由大到小的顺序为_______ 。
(4)铁酸钇是一种典型的单相多铁性材料,其正交晶胞结构如图a所示,沿z轴与x轴的投影图分别如图b和图c所示。

①该晶体中原子个数比为:
_______ 。
②若晶胞参数分别为a 、b
、b 、c
、c ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为_______  (列出计算表达式)。
(列出计算表达式)。
(1)铁在元素周期表第四周期
(2)铁形成的常见离子有
 和
和 ,
, 易被氧化为
易被氧化为 ,请利用核外电子排布的相关原理解释其原因:
,请利用核外电子排布的相关原理解释其原因:(3)检验
 是否被氧化为
是否被氧化为 的方法之一是取待测液,加入
的方法之一是取待测液,加入 溶液,观察是否有红色的
溶液,观察是否有红色的 生成。
生成。①
 中
中 的配位数为
的配位数为②配体
 中心C原子的杂化方式为:
中心C原子的杂化方式为:③O、N、S三种元素的电负性由大到小的顺序为
(4)铁酸钇是一种典型的单相多铁性材料,其正交晶胞结构如图a所示,沿z轴与x轴的投影图分别如图b和图c所示。

①该晶体中原子个数比为:

②若晶胞参数分别为a
 、b
、b 、c
、c ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
解题方法
3 . 前四周期元素及其化合物在生产、生活中应用广泛。回答下列问题:
(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是_______ 。
a. b.
b. c.
c.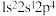 d.
d.
(2)基态铜原子的价电子排布式为_______ 。
(3) 的几何构型为
的几何构型为_______ ,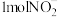 中含有的价层电子对数目为
中含有的价层电子对数目为_______ 。
(4)已知下图均与第三周期的主族元素有关。
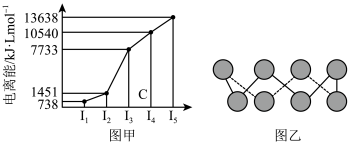
①图甲表示第一至第五电离能数据,则该元素的原子有_______ 种不同运动状态的电子。
②图乙中为某单质的一种同素异形体,分子中的各原子最外层均达到8电子稳定结构,则该元素的原子的杂化轨道类型为_______ ,其易溶于 的原因是
的原因是_______ 。
(5)氨气极易溶于水,溶于水的氨分子大部分与水分子形成氢键,生成一水合氨,关于一水合氨的结构有如下两种可能,正确的是b,理由是_______ 。

(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是
a.
 b.
b. c.
c.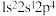 d.
d.
(2)基态铜原子的价电子排布式为
(3)
 的几何构型为
的几何构型为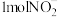 中含有的价层电子对数目为
中含有的价层电子对数目为(4)已知下图均与第三周期的主族元素有关。

①图甲表示第一至第五电离能数据,则该元素的原子有
②图乙中为某单质的一种同素异形体,分子中的各原子最外层均达到8电子稳定结构,则该元素的原子的杂化轨道类型为
 的原因是
的原因是(5)氨气极易溶于水,溶于水的氨分子大部分与水分子形成氢键,生成一水合氨,关于一水合氨的结构有如下两种可能,正确的是b,理由是

您最近一年使用:0次
解题方法
4 . 氮化锶(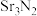 )是工业上生产荧光粉的原材料,遇水剧烈发生水解反应。实验室常用Sr和
)是工业上生产荧光粉的原材料,遇水剧烈发生水解反应。实验室常用Sr和 在加热条件下反应制得,某研究团队设计以下装置(夹持装置略去):
在加热条件下反应制得,某研究团队设计以下装置(夹持装置略去):

已知:锶与镁、钙同主族,锶能与水、 、
、 、
、 等快速发生反应。回答下列问题:
等快速发生反应。回答下列问题:
(1)实验装置中玻璃管之间需用橡皮管连接,其连接方法是先_______ ,然后稍稍用力转动即可把玻璃管插入橡皮管中。
(2)A装置中发生反应的化学方程式为_______ 。
(3)按气流从左到右的方向,装置连接的合理顺序为_______ →hi→_______ (填小写字母;装置可重复使用),连接顺序中装置E的作用是_______ 、_______ 。
(4)工业生产中欲使Sr反应完全,当吸收氮的作用减缓时将温度提高到700~750℃,分析可能的原因是_______ (写出一条即可)
(5)中美科学家合作发现钙和锶在 上吸附很强,同主族的Be与Mg不具备该性能。钙和锶可以均匀地覆盖在
上吸附很强,同主族的Be与Mg不具备该性能。钙和锶可以均匀地覆盖在 表面上形成
表面上形成 。
。 上可吸附至少92个氢分子(如图)。
上可吸附至少92个氢分子(如图)。

有关说法正确的是_______(填标号)。
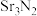 )是工业上生产荧光粉的原材料,遇水剧烈发生水解反应。实验室常用Sr和
)是工业上生产荧光粉的原材料,遇水剧烈发生水解反应。实验室常用Sr和 在加热条件下反应制得,某研究团队设计以下装置(夹持装置略去):
在加热条件下反应制得,某研究团队设计以下装置(夹持装置略去):
已知:锶与镁、钙同主族,锶能与水、
 、
、 、
、 等快速发生反应。回答下列问题:
等快速发生反应。回答下列问题:(1)实验装置中玻璃管之间需用橡皮管连接,其连接方法是先
(2)A装置中发生反应的化学方程式为
(3)按气流从左到右的方向,装置连接的合理顺序为
(4)工业生产中欲使Sr反应完全,当吸收氮的作用减缓时将温度提高到700~750℃,分析可能的原因是
(5)中美科学家合作发现钙和锶在
 上吸附很强,同主族的Be与Mg不具备该性能。钙和锶可以均匀地覆盖在
上吸附很强,同主族的Be与Mg不具备该性能。钙和锶可以均匀地覆盖在 表面上形成
表面上形成 。
。 上可吸附至少92个氢分子(如图)。
上可吸附至少92个氢分子(如图)。
有关说法正确的是_______(填标号)。
A.吸附相同数目氢分子时,储氢质量分数 比 比 高 高 |
B. 中碳原子杂化方式为 中碳原子杂化方式为 |
C. 储氢是与 储氢是与 发生加成反应 发生加成反应 |
| D.它们之间的相互作用机制可能与金属原子未占据的d轨道有关 |
您最近一年使用:0次
名校
解题方法
5 . 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
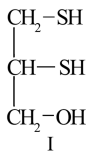

(1)H2S、CH4、H2O的沸点由高到低顺序为_______ 。
(2)汞的原子序数为80,位于元素周期表第_______ 周期第_______ 族。
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV_______ 硫酸(填“>”或“<”)
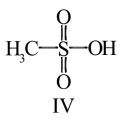
(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有_______ 。
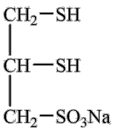
Ⅲ
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是_______ 。(填“化合物I”或“化合物Ⅲ”)


(1)H2S、CH4、H2O的沸点由高到低顺序为
(2)汞的原子序数为80,位于元素周期表第
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV

(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有

Ⅲ
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是
您最近一年使用:0次
名校
解题方法
6 . 下表为长式周期表的一部分其中的编号代表对应的元素。
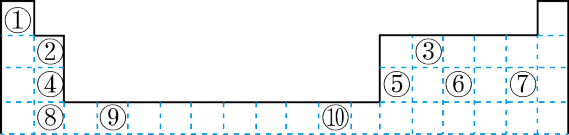
请回答下列问题:
(1)表中属于 ds 区的元素是___________ (填元素符号)它的基态原子的价电子排布式为___________ 。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为___________ ,其中元素③的基态原子的电子排布图为_______ ;①和⑥形成的一种常见四原子分子的化学式为_______ ,该分子的立体构型为______ 。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________ ;该元素与元素①形成的最简单分子 X 的电子式为___________ 。
(4)元素⑤的电负性___________ ④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________ 原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程___________ 。

请回答下列问题:
(1)表中属于 ds 区的元素是
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为
(4)元素⑤的电负性
(5)用电子式表示元素④和⑦组成的化合物的形成过程
您最近一年使用:0次
解题方法
7 . 含Ni、As元素的物质在生产生活中有重要的用途。回答下列问题:
(1)基态Ni2+核外电子排布式为________ 。
(2)AsCl3分子的立体构型为________ 。
(3)某个Ni(Ⅱ)有机配合物的结构如图所示:
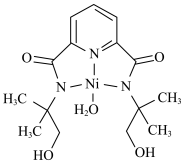
①该分子中N原子的杂化方式为________ 、________ 。
②请在图中用“→”标出Ni2+的配位键______ 。
(4)Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为________ 。
(5) 的酸性强于
的酸性强于 的原因是
的原因是______ ,AsH3的键角小于NH3的原因是________ 。
(6)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为________ ,已知晶胞参数分别为apm、apm、bpm和β=60°,则该晶胞的密度为________  (设阿伏加 德罗常数的值为NA)
(设阿伏加 德罗常数的值为NA)
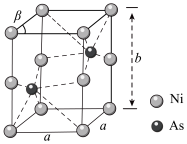
(1)基态Ni2+核外电子排布式为
(2)AsCl3分子的立体构型为
(3)某个Ni(Ⅱ)有机配合物的结构如图所示:

①该分子中N原子的杂化方式为
②请在图中用“→”标出Ni2+的配位键
(4)Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为
(5)
 的酸性强于
的酸性强于 的原因是
的原因是(6)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为
 (设阿伏加 德罗常数的值为NA)
(设阿伏加 德罗常数的值为NA)
您最近一年使用:0次
名校
解题方法
8 . 离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物。GaCl3和氯化1﹣乙基3﹣甲基咪唑(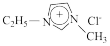 ,简称EMIC)混合形成的离子液体被认为是21世纪理想的绿色溶剂。请回答下列问题:
,简称EMIC)混合形成的离子液体被认为是21世纪理想的绿色溶剂。请回答下列问题:
(1)请写出基态Ga原子的核外电子排布式_____ 。同周期主族元素中基态原子未成对电子数与Ga相同的有_____ 。(填元素符号)。
(2)EMIC阳离子中的几种元素电负性由大到小顺序为_____ 。
(3)已知分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为_____ 。
(4)GaCl3熔点为77.8℃,GaF3熔点高于1000℃,其原因是_____ 。
(5)GaCl3和EMIC混合形成离子液体的过程中会存在以下转变:GaCl3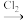 GaCl4
GaCl4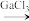 Ga2Cl7请写出Ga2Cl
Ga2Cl7请写出Ga2Cl 的结构式
的结构式_____ 。
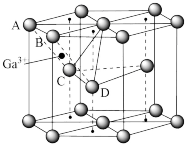
(6)某种Ga的氧化物晶胞结构如图所示。O2﹣以六方密堆积形成晶胞,Ga3+位于由A、C、D四个O2﹣围成的四边形的中心,但晶胞中只有的四边形中心位置占据了Ga3+,另外 的位置空置。
的位置空置。
①Ga3+位于O2﹣围成的_____ 面体空隙中。
②该晶胞中O2﹣的配位数为_____ 。
③若该晶胞的体积为Vcm3,该氧化物晶体密度为_____ 。
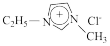 ,简称EMIC)混合形成的离子液体被认为是21世纪理想的绿色溶剂。请回答下列问题:
,简称EMIC)混合形成的离子液体被认为是21世纪理想的绿色溶剂。请回答下列问题:(1)请写出基态Ga原子的核外电子排布式
(2)EMIC阳离子中的几种元素电负性由大到小顺序为
(3)已知分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为(4)GaCl3熔点为77.8℃,GaF3熔点高于1000℃,其原因是
(5)GaCl3和EMIC混合形成离子液体的过程中会存在以下转变:GaCl3
 GaCl4
GaCl4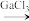 Ga2Cl7请写出Ga2Cl
Ga2Cl7请写出Ga2Cl 的结构式
的结构式(6)某种Ga的氧化物晶胞结构如图所示。O2﹣以六方密堆积形成晶胞,Ga3+位于由A、C、D四个O2﹣围成的四边形的中心,但晶胞中只有的四边形中心位置占据了Ga3+,另外
 的位置空置。
的位置空置。①Ga3+位于O2﹣围成的
②该晶胞中O2﹣的配位数为
③若该晶胞的体积为Vcm3,该氧化物晶体密度为

您最近一年使用:0次
2020-08-21更新
|
335次组卷
|
3卷引用:湖北省武汉市华中师大第一附中高考化学押题试卷
名校
解题方法
9 . 日前新合成的砷化镉(Cd3As2)三维材料具有超强导电性,这种材料的电气性能与石墨烯相当,可代替石墨烯使用。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为_______________ 。Cd原子中第一电离能相对较大的是_________ 原子(填“基态”或“激发态”)。
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3_________ PH3(填“>”或“<”),原因是______________ 。
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为_________ (用元素符号表示)。
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为_____________ ,1 mol对氨基苯胂酸含σ键数目为____________ ,其中还含有的化学键类型有___________ (填序号)。

a.氢键 b.离子键 c.π键
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。

建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_____ 。晶胞参数为a pm,阿伏加 德罗常数的值为NA,砷化镉的摩尔质量为M g·mol−1,则该晶胞的密度为_____________ g·cm−3(列计算式即可)。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为

a.氢键 b.离子键 c.π键
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。

建立如图的原子坐标系,①号位的坐标为(
 ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为
您最近一年使用:0次
2020-07-26更新
|
418次组卷
|
5卷引用:湖北省武汉市蔡甸区汉阳一中2020届高三全国高等学校仿真模拟(一)考试理综化学试题
湖北省武汉市蔡甸区汉阳一中2020届高三全国高等学校仿真模拟(一)考试理综化学试题(已下线)第十一单元 物质的结构与性质测试题-2021年高考化学一轮复习名师精讲练(已下线)学科网2020年5月高三大联考(新课标Ⅰ卷)化学试题湖南省岳阳市2021届高三二模考试化学试题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)
解题方法
10 . 钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Ti原子的价电子排布图为___________ 。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl。
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为_________ 。
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是___________ 。
③NH4Cl中存在的作用力有________ ,NH4Cl熔沸点高于CH3CH2OH的原因是________ ,Ti(OCH2CH3)4分子中C原子的杂化形式均为__________ 。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于__________ 位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为__________ m(列出表达式)。

(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Ti原子的价电子排布图为
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl。
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是
③NH4Cl中存在的作用力有
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于

您最近一年使用:0次



