名校
解题方法
1 . 铁元素单质及其化合物应用广泛,回答下列问题:
(1)纳米铁粉与高温水蒸气反应的化学方程式为__________ 。
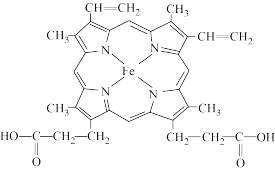
(2)血红素是血红蛋白的组成部分,结构如图所示。__________ 官能团形成血红蛋白(填名称)
②血红素中N的杂化方式为__________ ;
③CO、 与血红蛋白形成配位键更牢固的是
与血红蛋白形成配位键更牢固的是__________ 。
(3) 射线衍射得知四氧化三铁是反式尖晶石结构,可表示为
射线衍射得知四氧化三铁是反式尖晶石结构,可表示为 ,具有铁磁性和导电性。关于四氧化三铁导电性的解释正确的是
,具有铁磁性和导电性。关于四氧化三铁导电性的解释正确的是__________ 。
a.四氧化三铁是金属晶体,Fe原子失去价电子形成遍布整块晶体、自由移动的“电子气”
b.四氧化三铁是分子晶体,两种FeO和 分子能自由移动
分子能自由移动
c. 、
、 在八面体位置上呈无序排列的,电子可在铁的两种氧化态间迅速发生转移
在八面体位置上呈无序排列的,电子可在铁的两种氧化态间迅速发生转移
(4)如图所示, 晶体中,
晶体中, 采取立方最密堆积,围成正四面体空隙(如1、3、6、7等)和正八面体空隙。
采取立方最密堆积,围成正四面体空隙(如1、3、6、7等)和正八面体空隙。 中有一半的
中有一半的 填充在正四而体空隙中,
填充在正四而体空隙中, 和另一半
和另一半 填充在正八面体空隙中。有
填充在正八面体空隙中。有__________ %的正八面体空隙没有填充阳离子。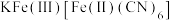 ](其摩尔质量为
](其摩尔质量为 )晶胞的1/8如下[
)晶胞的1/8如下[ 未标出,占据四个互不相邻的小立方体(晶胞的1/8部分)的体心】。若该晶体的密度为
未标出,占据四个互不相邻的小立方体(晶胞的1/8部分)的体心】。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为__________ cm( 为阿伏伽德罗常数的值,写表达式)。
为阿伏伽德罗常数的值,写表达式)。
(1)纳米铁粉与高温水蒸气反应的化学方程式为
(2)血红素是血红蛋白的组成部分,结构如图所示。
②血红素中N的杂化方式为
③CO、
 与血红蛋白形成配位键更牢固的是
与血红蛋白形成配位键更牢固的是(3)
 射线衍射得知四氧化三铁是反式尖晶石结构,可表示为
射线衍射得知四氧化三铁是反式尖晶石结构,可表示为 ,具有铁磁性和导电性。关于四氧化三铁导电性的解释正确的是
,具有铁磁性和导电性。关于四氧化三铁导电性的解释正确的是a.四氧化三铁是金属晶体,Fe原子失去价电子形成遍布整块晶体、自由移动的“电子气”
b.四氧化三铁是分子晶体,两种FeO和
 分子能自由移动
分子能自由移动c.
 、
、 在八面体位置上呈无序排列的,电子可在铁的两种氧化态间迅速发生转移
在八面体位置上呈无序排列的,电子可在铁的两种氧化态间迅速发生转移(4)如图所示,
 晶体中,
晶体中, 采取立方最密堆积,围成正四面体空隙(如1、3、6、7等)和正八面体空隙。
采取立方最密堆积,围成正四面体空隙(如1、3、6、7等)和正八面体空隙。 中有一半的
中有一半的 填充在正四而体空隙中,
填充在正四而体空隙中, 和另一半
和另一半 填充在正八面体空隙中。有
填充在正八面体空隙中。有
 ](其摩尔质量为
](其摩尔质量为 )晶胞的1/8如下[
)晶胞的1/8如下[ 未标出,占据四个互不相邻的小立方体(晶胞的1/8部分)的体心】。若该晶体的密度为
未标出,占据四个互不相邻的小立方体(晶胞的1/8部分)的体心】。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏伽德罗常数的值,写表达式)。
为阿伏伽德罗常数的值,写表达式)。
您最近一年使用:0次
2 . 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1) 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为_____ , 水解反应的产物为
水解反应的产物为_____ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键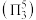 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式_____ ;为 键角
键角_____  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_____ 。
(3)一定条件下, 和
和 反应生成
反应生成 和化合物
和化合物 。已知
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数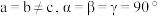 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为_____ 。若阿伏伽德罗常数的值为 ,化合物
,化合物 的密度
的密度
_____  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)
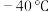 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键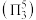 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)一定条件下,
 和
和 反应生成
反应生成 和化合物
和化合物 。已知
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数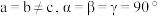 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为 ,化合物
,化合物 的密度
的密度
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-06-19更新
|
10477次组卷
|
10卷引用:2023年高考山东卷化学真题
2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(结构与性质)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第11讲 氯气和卤族元素(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)(已下线)第20讲化学键(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用) 河南省南阳市第一中学校2024届高三上学期阶段检测化学试题(12月)
名校
解题方法
3 . 我国煤储量居世界第一,对煤的综合、高效、无害化利用是二十一世纪能源战略的重要组成部分,利用含铁元素的粉煤灰获得纳米 等重要物质的工艺流程如下。
等重要物质的工艺流程如下。
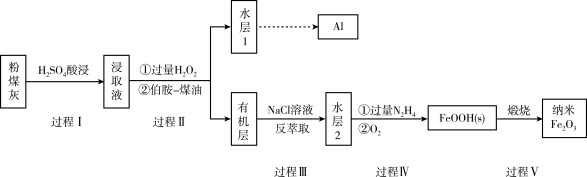
已知:i:伯胺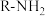 能与
能与 反应:
反应: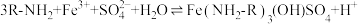 生成易溶于煤油的产物。
生成易溶于煤油的产物。
ii: 在水溶液中易与
在水溶液中易与 反应:
反应: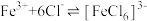
(1)写出过程I中 发生反应的离子方程式:
发生反应的离子方程式:_______ 。
(2)过程Ⅱ加入过量 的作用是
的作用是_______ 。
(3)过程Ⅱ加入伯胺-煤油对浸取液进行分离,该操作的名称是_______ 。
(4)从化学平衡角度解释过程Ⅱ利用 溶液进行反萃取的原理:
溶液进行反萃取的原理:_______ 。
(5) 具有碱性,可与
具有碱性,可与 结合生成
结合生成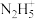 ,其中氮原子的杂化类型为
,其中氮原子的杂化类型为_______ 从结构角度分析,它比 配位能力
配位能力_______ (“强”或“弱”),过程Ⅳ中先用过量的 将水层2中
将水层2中 转化为
转化为 并生成
并生成 ,反应的离子方程式为
,反应的离子方程式为_______ ,得到的 再被
再被 氧化为
氧化为 。
。
(6)以 溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的
溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的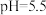 ,将烟气中的
,将烟气中的 、
、 转化为
转化为 、
、 ,均为放热反应。
,均为放热反应。
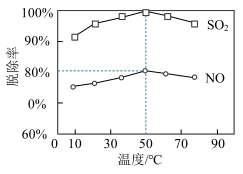
①一定时间内,温度对硫、硝脱除率的影响曲线如下图, 的脱除率高于
的脱除率高于 ,可能的原因是
,可能的原因是_______ (写出1种即可)。
②烟气中 和
和 的体积比为
的体积比为 ,
, 时的脱除率见图,则此吸收液中烟气转化生成的
时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为_______ 。
 等重要物质的工艺流程如下。
等重要物质的工艺流程如下。
已知:i:伯胺
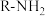 能与
能与 反应:
反应: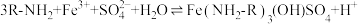 生成易溶于煤油的产物。
生成易溶于煤油的产物。ii:
 在水溶液中易与
在水溶液中易与 反应:
反应: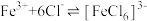
(1)写出过程I中
 发生反应的离子方程式:
发生反应的离子方程式:(2)过程Ⅱ加入过量
 的作用是
的作用是(3)过程Ⅱ加入伯胺-煤油对浸取液进行分离,该操作的名称是
(4)从化学平衡角度解释过程Ⅱ利用
 溶液进行反萃取的原理:
溶液进行反萃取的原理:(5)
 具有碱性,可与
具有碱性,可与 结合生成
结合生成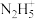 ,其中氮原子的杂化类型为
,其中氮原子的杂化类型为 配位能力
配位能力 将水层2中
将水层2中 转化为
转化为 并生成
并生成 ,反应的离子方程式为
,反应的离子方程式为 再被
再被 氧化为
氧化为 。
。(6)以
 溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的
溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的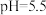 ,将烟气中的
,将烟气中的 、
、 转化为
转化为 、
、 ,均为放热反应。
,均为放热反应。①一定时间内,温度对硫、硝脱除率的影响曲线如下图,
 的脱除率高于
的脱除率高于 ,可能的原因是
,可能的原因是②烟气中
 和
和 的体积比为
的体积比为 ,
, 时的脱除率见图,则此吸收液中烟气转化生成的
时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2023-05-28更新
|
574次组卷
|
2卷引用:北京首都师范大学附属中学2023届高三3月月考化学试题
解题方法
4 . 以有机物A为原料合成药物F的路线如下:

回答下列问题:
(1)A分子中碳原子的杂化方式为___________ ,用*标记A分子中含有的手性碳原子:___________ 。
(2)试剂X的分子式为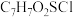 ,写出试剂X的结构简式:
,写出试剂X的结构简式:___________ , 的反应类型为
的反应类型为___________ 。
(3)反应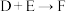 中,每1molD参与反应,产生1molHBr,写出
中,每1molD参与反应,产生1molHBr,写出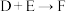 的反应的化学方程式:
的反应的化学方程式:___________ 。
(4)在C的同分异构体中,同时满足下列条件的有___________ 种(不含立体异构),其中核磁共振氢谱显示有6组氢(氢原子数目比为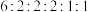 )的结构简式为
)的结构简式为___________ (写一种)。
①含有苯环和2个甲基,苯环上只有2个对位取代基(不是甲基);
②与 溶液不发生显色反应,但能与金属钠反应生成气体;
溶液不发生显色反应,但能与金属钠反应生成气体;
③能发生银镜反应,不能发生水解反应。
(5)参照上述合成路线,设计以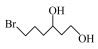
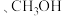 为原料制备
为原料制备 的合成路线:
的合成路线:___________ (无机试剂和有机溶剂任用)。

回答下列问题:
(1)A分子中碳原子的杂化方式为
(2)试剂X的分子式为
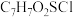 ,写出试剂X的结构简式:
,写出试剂X的结构简式: 的反应类型为
的反应类型为(3)反应
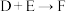 中,每1molD参与反应,产生1molHBr,写出
中,每1molD参与反应,产生1molHBr,写出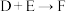 的反应的化学方程式:
的反应的化学方程式:(4)在C的同分异构体中,同时满足下列条件的有
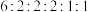 )的结构简式为
)的结构简式为①含有苯环和2个甲基,苯环上只有2个对位取代基(不是甲基);
②与
 溶液不发生显色反应,但能与金属钠反应生成气体;
溶液不发生显色反应,但能与金属钠反应生成气体;③能发生银镜反应,不能发生水解反应。
(5)参照上述合成路线,设计以

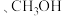 为原料制备
为原料制备 的合成路线:
的合成路线:
您最近一年使用:0次
名校
解题方法
5 . 碳的化合物在工业上应用广泛。
I. 和乙烷反应制备乙烯。
和乙烷反应制备乙烯。
298K时,相关物质的相对能量如图,

(1) 与乙烷反应生成乙烯、CO和气态水的热化学方程式为
与乙烷反应生成乙烯、CO和气态水的热化学方程式为_______ 。
II. 制甲醇。以
制甲醇。以 作催化剂,可使
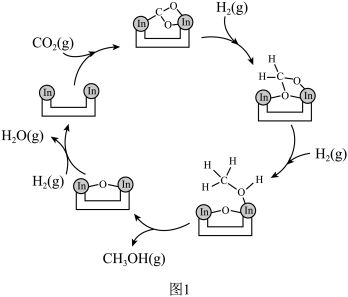
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:
i.催化剂活化: (无活性)
(无活性) (有活性)
(有活性)
ii. 与在活化后的催化剂表面可逆的发生反应①:
与在活化后的催化剂表面可逆的发生反应①:
 ,其反应历程如图1。
,其反应历程如图1。
同时伴随反应②:
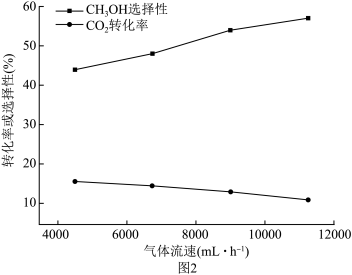
(2) 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。
已知: 选择性
选择性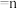 (生成
(生成 所消耗的
所消耗的 的量)
的量)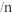 (发生转化的
(发生转化的 的量)。
的量)。 选择性随流速增大而升高的原因是
选择性随流速增大而升高的原因是_______ 。同时,流速加快可减少产物中 的积累,减少反应
的积累,减少反应_______ (用化学方程式表示)的发生,减少催化剂的失活,提高甲醇选择性。
(3)对于以上 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。
III.甲烷重整制合成气,主要反应如下:
i.

ii.

各反应平衡常数与温度的关系如图。
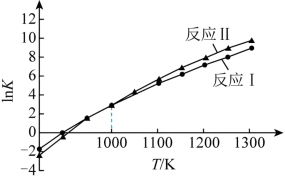
(4)①假设 、
、 不随温度变化,平衡常数与温度间存在的关系为:
不随温度变化,平衡常数与温度间存在的关系为: ,R为正常数。则
,R为正常数。则
_______ 0(填“>”或“<”);
_______  (填“>”或“<”)。
(填“>”或“<”)。
②通过调整投料比可调控平衡时合成气 的值。1000K,平衡时
的值。1000K,平衡时 ,则
,则
_______ ,应控制投料比
_______ 。
I.
 和乙烷反应制备乙烯。
和乙烷反应制备乙烯。298K时,相关物质的相对能量如图,

(1)
 与乙烷反应生成乙烯、CO和气态水的热化学方程式为
与乙烷反应生成乙烯、CO和气态水的热化学方程式为II.
 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:i.催化剂活化:
 (无活性)
(无活性) (有活性)
(有活性)ii.
 与在活化后的催化剂表面可逆的发生反应①:
与在活化后的催化剂表面可逆的发生反应①:
 ,其反应历程如图1。
,其反应历程如图1。
同时伴随反应②:

(2)
 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。
已知:
 选择性
选择性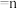 (生成
(生成 所消耗的
所消耗的 的量)
的量) (发生转化的
(发生转化的 的量)。
的量)。 选择性随流速增大而升高的原因是
选择性随流速增大而升高的原因是 的积累,减少反应
的积累,减少反应(3)对于以上
 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。| A.碳的杂化方式没有发生改变 |
B.反应中经历了 、 、 键的形成和断裂 键的形成和断裂 |
C.加压可以提高 的平衡转化率 的平衡转化率 |
| D.升高温度可以提高甲醇在平衡时的选择性 |
III.甲烷重整制合成气,主要反应如下:
i.


ii.


各反应平衡常数与温度的关系如图。

(4)①假设
 、
、 不随温度变化,平衡常数与温度间存在的关系为:
不随温度变化,平衡常数与温度间存在的关系为: ,R为正常数。则
,R为正常数。则

 (填“>”或“<”)。
(填“>”或“<”)。②通过调整投料比可调控平衡时合成气
 的值。1000K,平衡时
的值。1000K,平衡时 ,则
,则

您最近一年使用:0次
名校
解题方法
6 . 铁在工业中有重要作用,也是人体必需的微量元素。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式_______ 。
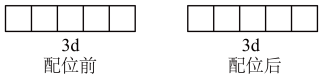
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为_______ ,配离子中Fe3+为d2sp3杂化,写出配位前后Fe3+3d轨道表示式_______ 。
(2)邻二氮菲的结构简式为 ,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
①中心离子的配位数为_______ ,配位原子的杂化方式为_______ 。
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因_______
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。
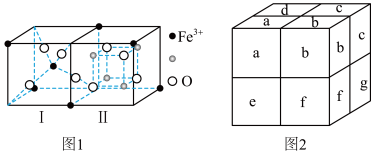
①Fe3O4晶胞中有_______ 个Fe离子, 代表
代表_______ 。
②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为_______ g/cm3。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为

(2)邻二氮菲的结构简式为
 ,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。①中心离子的配位数为
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。

①Fe3O4晶胞中有
 代表
代表②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为
您最近一年使用:0次
解题方法
7 . 现代科技的发展离不开材料的开发与应用,而物质结构理论是材料研究的基础,请回答Ⅰ-Ⅳ的问题。
Ⅰ.使用 作原科的电合成技术,为减少
作原科的电合成技术,为减少 排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
(1) 和
和 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_______________ 和_______________ 。
(2)1个 分子中存在
分子中存在_______________ 个 键。
键。
(3) 易溶于水的原因是
易溶于水的原因是_____________________ 。
Ⅱ.硒( )与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
)与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
(4)在基态K原子中,能量最低的空轨道的符号是_____ , 原子的价电子排布式为
原子的价电子排布式为______ 。
(5) 的空间构型为
的空间构型为___________ ,写出一个与 互为等电子体的分子
互为等电子体的分子_____ (填分子式)。
(6)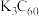 是一种超导材料,是由足球烯(
是一种超导材料,是由足球烯( )与金属钾反应生成的盐。在
)与金属钾反应生成的盐。在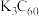 晶胞中,
晶胞中,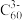 堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,
堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙, 填充在空隙中。晶胞中被
填充在空隙中。晶胞中被 占据的空隙百分比为
占据的空隙百分比为_______________ 。

Ⅲ.咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:

(7)上述三种物质中,沸点最高的是_______________ (填化学名称)。
(8)已知咪唑中存在大 键,则在咪唑分子的两个氮原子中,更容易与
键,则在咪唑分子的两个氮原子中,更容易与 形成配位键的是
形成配位键的是_______________ (填“①”或“②”)号氮原子。
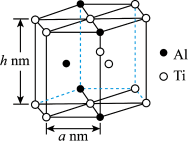
Ⅳ.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示( 、
、 原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为
原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为 ,该合金的密度为
,该合金的密度为 。
。
(9)列出
_____ cm的计算式,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
Ⅰ.使用
 作原科的电合成技术,为减少
作原科的电合成技术,为减少 排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。(1)
 和
和 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(2)1个
 分子中存在
分子中存在 键。
键。(3)
 易溶于水的原因是
易溶于水的原因是Ⅱ.硒(
 )与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
)与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。(4)在基态K原子中,能量最低的空轨道的符号是
 原子的价电子排布式为
原子的价电子排布式为(5)
 的空间构型为
的空间构型为 互为等电子体的分子
互为等电子体的分子(6)
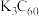 是一种超导材料,是由足球烯(
是一种超导材料,是由足球烯( )与金属钾反应生成的盐。在
)与金属钾反应生成的盐。在 晶胞中,
晶胞中, 堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,
堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙, 填充在空隙中。晶胞中被
填充在空隙中。晶胞中被 占据的空隙百分比为
占据的空隙百分比为
Ⅲ.咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:

(7)上述三种物质中,沸点最高的是
(8)已知咪唑中存在大
 键,则在咪唑分子的两个氮原子中,更容易与
键,则在咪唑分子的两个氮原子中,更容易与 形成配位键的是
形成配位键的是Ⅳ.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(
 、
、 原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为
原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为 ,该合金的密度为
,该合金的密度为 。
。(9)列出
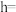
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
您最近一年使用:0次
解题方法
8 . 含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态 原子的电子所占据的最高能层符号为
原子的电子所占据的最高能层符号为_______ ,基态 较基态
较基态 心稳定的原因是
心稳定的原因是_______ ;
(2) 稀溶液中存在
稀溶液中存在 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。
(3) 可形成
可形成 ,其中
,其中 代表
代表 。该化合物分子中,
。该化合物分子中, 模型为四面体的非金属原子共有
模型为四面体的非金属原子共有___ 个;C、N、F的电负性由大到小的顺序为____ ;
(4)一种由 组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中
组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中 原子填充在
原子填充在 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为_____ ;该晶体的化学式为_____ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点,B点原子的分数坐标分别为 、
、 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_____ 晶胞中C、D间距离
_____  。
。

(1)基态
 原子的电子所占据的最高能层符号为
原子的电子所占据的最高能层符号为 较基态
较基态 心稳定的原因是
心稳定的原因是(2)
 稀溶液中存在
稀溶液中存在 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。A. | B. | C. | D. |
 可形成
可形成 ,其中
,其中 代表
代表 。该化合物分子中,
。该化合物分子中, 模型为四面体的非金属原子共有
模型为四面体的非金属原子共有(4)一种由
 组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中
组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中 原子填充在
原子填充在 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为 、
、 ,则C点原子的分数坐标为
,则C点原子的分数坐标为
 。
。
您最近一年使用:0次
名校
解题方法
9 . 研究和深度开发氮氧化物、碳氧化物、硫及其化合物的应用对构建生态文明社会具有重要的意义。
Ⅰ.NO会加速臭氧层被破坏,其反应过程如图所示:

(1)NO的作用是____ 。
(2)已知:O3(g)+O(g) 2O2 ΔH=-143kJ·mol-l
2O2 ΔH=-143kJ·mol-l
反应1:O3+NO NO2+O2 ΔH1=-200.2kJ·mol-l
NO2+O2 ΔH1=-200.2kJ·mol-l
反应2:热化学方程式为____ 。
Ⅱ.已知反应:H2S(g)+CO(g) COS(g)+H2(g) ΔH<0。
COS(g)+H2(g) ΔH<0。
(3)COS(羰基硫)中心原子的杂化方式为____ ,写出COS(羰基硫)的电子式___ 。H2O中的H—O—H键角____ (填“>”、“=”或“<”)H2S中的H—S—H键角。
(4)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。
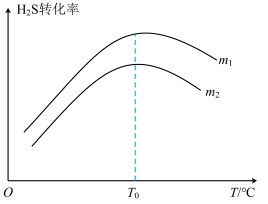
①m1____ m2.(填“>”、“<”或“=”)
②温度高于T0时,H2S转化率减小的可能原因为___ 。
A.反应停止了 B.催化剂活性降低 C.反应达到平衡 D.反应的ΔH变大
③240℃时,将等物质的量的H2S(g)与CO(g)充入密闭容器中,测得H2(g)的平衡体积分数为25%。则此时该反应的平衡常数K=___ 。
④在300℃、320℃时上述反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图所示。起始密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等。则300℃时ω[COS(g)]随时间变化的曲线为_____ ,320℃时ω[H2S(g)]随时间变化的曲线为____ 。

Ⅰ.NO会加速臭氧层被破坏,其反应过程如图所示:

(1)NO的作用是
(2)已知:O3(g)+O(g)
 2O2 ΔH=-143kJ·mol-l
2O2 ΔH=-143kJ·mol-l反应1:O3+NO
 NO2+O2 ΔH1=-200.2kJ·mol-l
NO2+O2 ΔH1=-200.2kJ·mol-l反应2:热化学方程式为
Ⅱ.已知反应:H2S(g)+CO(g)
 COS(g)+H2(g) ΔH<0。
COS(g)+H2(g) ΔH<0。(3)COS(羰基硫)中心原子的杂化方式为
(4)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。

①m1
②温度高于T0时,H2S转化率减小的可能原因为
A.反应停止了 B.催化剂活性降低 C.反应达到平衡 D.反应的ΔH变大
③240℃时,将等物质的量的H2S(g)与CO(g)充入密闭容器中,测得H2(g)的平衡体积分数为25%。则此时该反应的平衡常数K=
④在300℃、320℃时上述反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图所示。起始密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等。则300℃时ω[COS(g)]随时间变化的曲线为

您最近一年使用:0次
解题方法
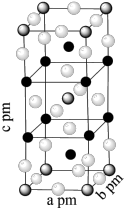
10 . 磁性材料广泛应用于航空航天高科技领域及电视、电脑、手机等日常生活用品。据报道,苯并[18]冠-6(以X表示,图1)与铯离子可形成一种夹心型的超分子阳离子,它与镍的配合物[Ni(dmit)2]-(以Y表示,图2)结合后可形成复合物并产生独特的晶体结构,具有优越的磁学性能,是铁磁性和反铁磁性共存于同一晶体中的成功范例。

下图是X、Y与Cs+形成的复合物的晶体结构。在此晶体结构图中,a)为沿b轴看晶胞,b)为沿a轴看晶胞,c)为在c=0的面上镍配合物的二维排列,d)为镍配合物的π-二聚体链。

(1)给出该晶体晶胞的组成,并写出该晶体结构基元的化学式_______ (苯并[18]冠-6用X表示,镍配合物用Y表示)。
(2)指出镍离子的杂化轨道类型:_______ 。如图是平面正方形晶体场d轨道能级分裂图,把基态镍离子的d电子填入该图_______ 。

(3)已知该晶体的晶胞参数a=1278.99pm,b=1305.39pm,c=2717.03pm,α=78.3394°,β=77.0109°,r=70.6358°,试计算该晶体的密度_______ g·cm-3.(相对分子质量:X312.4;Y451.4)
(4)①写出镍配合物Y的对称元素_______ 。
②指出超分子阳离子中Cs+的配位数,解释其配位数较大的可能原因_______ 。

下图是X、Y与Cs+形成的复合物的晶体结构。在此晶体结构图中,a)为沿b轴看晶胞,b)为沿a轴看晶胞,c)为在c=0的面上镍配合物的二维排列,d)为镍配合物的π-二聚体链。

(1)给出该晶体晶胞的组成,并写出该晶体结构基元的化学式
(2)指出镍离子的杂化轨道类型:

(3)已知该晶体的晶胞参数a=1278.99pm,b=1305.39pm,c=2717.03pm,α=78.3394°,β=77.0109°,r=70.6358°,试计算该晶体的密度
(4)①写出镍配合物Y的对称元素
②指出超分子阳离子中Cs+的配位数,解释其配位数较大的可能原因
您最近一年使用:0次



