名校
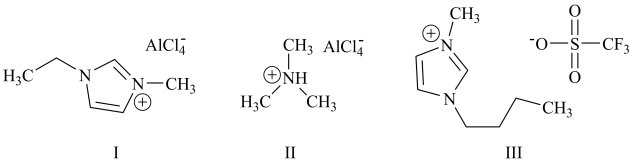
1 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________(填编号)。
(3)化合物I中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物III中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为_____ 。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为______ g·cm-3(列出计算式)。
(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为___________(填编号)。
A.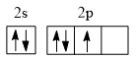 | B.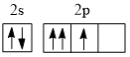 | C.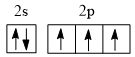 | D.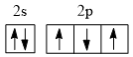 |
(4)化合物III中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。
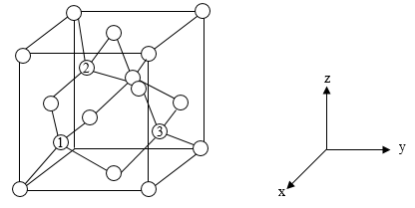
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(
 ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
2022-03-17更新
|
2764次组卷
|
10卷引用:吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题
吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题广东省广州市2022届高三一模考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国乙卷)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)江西省新余市2022届高三第二次模拟考试理综化学试题(已下线)广东省广州市2022届高三一模考试(结构与性质)广东省广州市2021-2022学年高三下学期一模考试化学试题2024届四川省兴文第二中学校高三上学期一诊模拟考试理综试题(已下线)热点25 物质结构与性质综合题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
2 . 氯仿 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气 :
: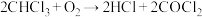 ,其中光气的结构式如图所示,下列说法不正确的是
,其中光气的结构式如图所示,下列说法不正确的是
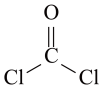
 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气 :
: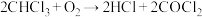 ,其中光气的结构式如图所示,下列说法不正确的是
,其中光气的结构式如图所示,下列说法不正确的是
A. 分子为含极性键的正四面体形分子 分子为含极性键的正四面体形分子 |
B. 分子中含有3个σ键、1个π键,中心C原子采取 分子中含有3个σ键、1个π键,中心C原子采取 杂化 杂化 |
C. 分子中所有原子的最外层都满足8电子稳定结构 分子中所有原子的最外层都满足8电子稳定结构 |
D.使用氯仿前可用 稀溶液检验氯仿是否变质 稀溶液检验氯仿是否变质 |
您最近一年使用:0次
2021-02-16更新
|
1768次组卷
|
8卷引用:吉林省长春市第二实验中学2021-2022学年高二下学期开学考试化学试题
名校
3 . 半导体材料是半导体⼯业的基础,由第ⅢA和第ⅤA元素所形成的化合物在半导体材料领域有⼴泛的应⽤。如砷化镓(GaAs)、砷化硼(BAs)、砷化铝(AlAs),氮化镓(GaN)等。请根据第ⅢA和第ⅤA元素核外电⼦排布的特点和形成化学键的多样性等特点回答下列问题:
(1)基态As原⼦的电⼦排布式为[Ar]___________ 。Ga、As和Se的第⼀电离能由小到大的顺序是:___________ 。
(2)实验发现,氯化铝的蒸⽓或溶于⾮极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原⼦采取___________ 杂化。
②Al2Cl6与过量NaOH溶液反应⽣成 ,
, -中存在的化学作⽤⼒类型有
-中存在的化学作⽤⼒类型有___________ (填标号)。
A.离⼦键 B.极性共价键 C.⾦属键 D.非极性共价键 E.配位键 F. 键 G.氢键
键 G.氢键
(3)N、B可以分别形成化合物NF3和BF3,试判断两种分⼦中键角的大小:NF3___________ BF3(填“>”、“<”、“=”)。
(4)⾃然界中不存在单质硼,硼的氢化物也很少,主要以含氧化合物形式存在,根据下表数据分析原因是___________ 。
(5)GaN是第三代半导体材料的研究热点,在⼲燥的NH3⽓流中焙烧磨细的GaAs可制得GaN。GaN、GaP、GaAs晶体类型与SiC相似,熔点如下表所示,其熔点差异的原因是___________ 。
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形A´C´CA是沿晶胞对⻆⾯取得的截图。

①若晶胞的边长均为apm,阿伏加德罗常数的值为NA,晶体的密度为___________ g·cm-3(列出计算表达式)。
②晶胞中各原⼦在矩形A´C´CA的位置为___________ (填标号)。
A. B.
B.
C. D.
D.
(1)基态As原⼦的电⼦排布式为[Ar]
(2)实验发现,氯化铝的蒸⽓或溶于⾮极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原⼦采取
②Al2Cl6与过量NaOH溶液反应⽣成
 ,
, -中存在的化学作⽤⼒类型有
-中存在的化学作⽤⼒类型有A.离⼦键 B.极性共价键 C.⾦属键 D.非极性共价键 E.配位键 F.
 键 G.氢键
键 G.氢键(3)N、B可以分别形成化合物NF3和BF3,试判断两种分⼦中键角的大小:NF3
(4)⾃然界中不存在单质硼,硼的氢化物也很少,主要以含氧化合物形式存在,根据下表数据分析原因是
| 化学键 | B—H | B—O | B—B |
| 键能(kJ/mol) | 389 | 561 | 293 |
| 物质 | GaN | GaP | GaAs |
| 熔点/℃ | 1700 | 1480 | 1238 |

①若晶胞的边长均为apm,阿伏加德罗常数的值为NA,晶体的密度为
②晶胞中各原⼦在矩形A´C´CA的位置为
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
2022-06-03更新
|
665次组卷
|
3卷引用:东北师范大学附属中学2022届高三考前模拟预测化学试题
东北师范大学附属中学2022届高三考前模拟预测化学试题(已下线)专题17 物质结构与性质综合题-备战2023年高考化学母题题源解密(全国通用)黑龙江省佳木斯市第十二中学2022-2023学年高三上学期期中考试化学试题
2022高二·全国·专题练习
名校
解题方法
4 . 顺铂[Pt(NH3)2Cl2]是1969年发现的第一种具有抗癌活性的金属化合物;碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构简式如图所示,其毒副作用低于顺铂。已知NA表示阿伏加德罗常数的值,下列说法正确的是
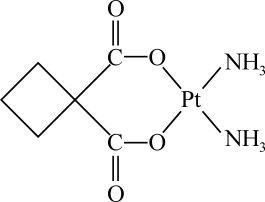
碳铂

碳铂
| A.碳铂中所有碳原子在同一个平面中 |
| B.碳铂分子属于手性分子 |
| C.碳铂分子中sp3杂化的碳原子与sp2杂化的碳原子数之比为2∶1 |
| D.1 mol顺铂中含有σ键的数目为12NA(配位键属于σ键) |
您最近一年使用:0次
2022-04-04更新
|
587次组卷
|
4卷引用:吉林省吉化第一高级中学校2021-2022学年高二上学期期末考试化学试题
吉林省吉化第一高级中学校2021-2022学年高二上学期期末考试化学试题(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)河北省石家庄市第二中学2022年高二寒假考试化学试题湖南省湖南师范大学附属中学2021-2022学年高二上学期期末考试化学试题
名校
5 . 徐光宪在《分子共和国》一书中介绍了许多明星分子,如 、
、 、
、 、
、 等。下列说法正确的是
等。下列说法正确的是
 、
、 、
、 、
、 等。下列说法正确的是
等。下列说法正确的是A. 分子中的O为 分子中的O为 杂化 杂化 |
B. 分子中的C原子为sp杂化 分子中的C原子为sp杂化 |
C. 分子中的B原子为 分子中的B原子为 杂化 杂化 |
D. 分子中的C原子均为 分子中的C原子均为 杂化 杂化 |
您最近一年使用:0次
2022-05-05更新
|
479次组卷
|
17卷引用:吉林省实验中学2021-2022学年高二下学期线上质量检测化学试题
吉林省实验中学2021-2022学年高二下学期线上质量检测化学试题吉林省辽源市东辽县第一高级中学2019-2020高二5月月考化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第30讲 分子结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)【全国百强校】福建省厦门市外国语学校2018-2019学年高二(理)上学期期中考试化学试题辽宁省葫芦岛市2018-2019学年高二下学期学业质量监测(期末)化学试题(已下线)专题11.2 分子结构与性质(讲)-《2020年高考一轮复习讲练测》福建省厦门外国语学校2018-2019学年高二下学期期中考试化学试题辽宁省葫芦岛市普通高中2019-2020高二上学期期末质量测试化学试题(已下线)第36讲 分子结构与性质(精讲)-2021年高考化学一轮复习讲练测(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构(人教版2019)选择性必修2 第二章 分子结构与性质 学科素养提升鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2章学科素养提升(已下线)考点34 分子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)江西省新余市第一中学2022-2023高二上学期期末考试化学试题湖南省长沙市雅礼中学2022-2023学年高二下学期期中考试化学试题广东省揭阳市三所中学联考2022-2023学年高二下学期4月期中考试化学试题
解题方法
6 . 2022年9月9日,国家航天局、国家原子能机构联合在北京发布“嫦娥五号”最新科学成果:中国科学家首次在月球上发现新矿物,并命名为“嫦娥石”。“嫦娥石”是一种新的磷酸盐矿物,属于陨磷钠镁钙石(Merrillite)族,颗粒约2~30微米,伴生矿物有钛铁矿等。回答下列问题:
(1)基态钛原子价电子排布式为_______ 。
(2)Fe的配合物有多种。 、
、 、
、 的配体中所含原子C、N、O、F电负性由大到小的顺序是
的配体中所含原子C、N、O、F电负性由大到小的顺序是_______ (写元素符号,下同);第一电离能由大到小的顺序为_______ 。
(3)磷酸为磷的最高价含氧酸,其空间结构如图:
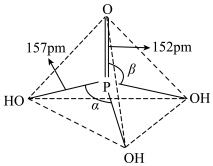
①纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是_______ 。
② 的立体构型为
的立体构型为_______ ,中心原子的杂化类型是_______ 。
(4)反型钙钛矿电池无须使用具有光催化活性的 (通过氮掺杂生成
(通过氮掺杂生成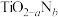 ,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
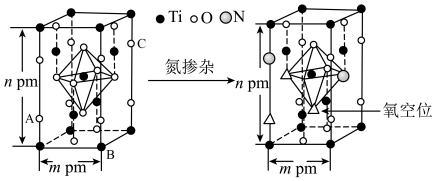
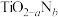 晶体中
晶体中
_______ ;已知原子A、B的分数坐标分别为 和
和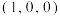 ,则原子C的坐标为
,则原子C的坐标为_______ ,设阿伏加德罗常数的值为 ,
, 的密度为
的密度为_______ g·cm 。
。
(1)基态钛原子价电子排布式为
(2)Fe的配合物有多种。
 、
、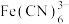 、
、 的配体中所含原子C、N、O、F电负性由大到小的顺序是
的配体中所含原子C、N、O、F电负性由大到小的顺序是(3)磷酸为磷的最高价含氧酸,其空间结构如图:

①纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是
②
 的立体构型为
的立体构型为(4)反型钙钛矿电池无须使用具有光催化活性的
 (通过氮掺杂生成
(通过氮掺杂生成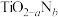 ,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
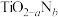 晶体中
晶体中
 和
和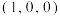 ,则原子C的坐标为
,则原子C的坐标为 ,
, 的密度为
的密度为 。
。
您最近一年使用:0次
2023-01-02更新
|
391次组卷
|
3卷引用:吉林省部分学校2022-2023学年高三上学期12月联考化学试题
名校
解题方法
7 . 化学在生产、生活和科研中应用广泛。回答下列问题:
(1)基态Ti原子的电子所占据的最高能层符号为_______ ,N、O、Cu的电负性由大到小的顺序是_______ 。
(2)利用TiO2纳米管的光电实验可制备TNT(2,4,6-三硝基甲苯),其结构如图,N原子的杂化类型为_______ 。TNT常温下是固体,而甲苯是液体,原因是_______ 。

(3)GaCl3·xNH3(x=3,4,5,6)是一系列化合物,向含1molGaCl3·xNH3的溶液中加入足量AgNO3溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有 4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1:2。
①NH3的VSEPR模型为_______ 。
②GaCl3·xNH3含有的化学键类型有_______ (填序号)。
A极性共价键 B.配位键 C.金属键 D.氢键
③能准确表示GaCl3·xNH3结构的化学式为_______ 。
(4)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:
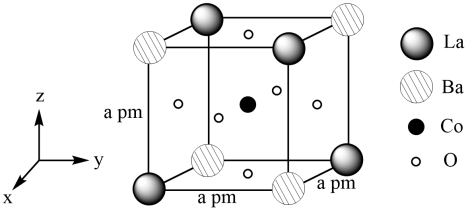
①该晶体的一个完整晶胞中含有_______ 个 Co原子
②真实的晶体中存在5%的O原子缺陷,从而能让O2−在其中传导,已知La为+3价,Ba为+2价,则+3价Co与+4价Co的原子个数比为_______ ,设阿伏加德罗常数为NA,则晶体的密度为_______ g/cm3。
(1)基态Ti原子的电子所占据的最高能层符号为
(2)利用TiO2纳米管的光电实验可制备TNT(2,4,6-三硝基甲苯),其结构如图,N原子的杂化类型为

(3)GaCl3·xNH3(x=3,4,5,6)是一系列化合物,向含1molGaCl3·xNH3的溶液中加入足量AgNO3溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有 4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1:2。
①NH3的VSEPR模型为
②GaCl3·xNH3含有的化学键类型有
A极性共价键 B.配位键 C.金属键 D.氢键
③能准确表示GaCl3·xNH3结构的化学式为
(4)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:

①该晶体的一个完整晶胞中含有
②真实的晶体中存在5%的O原子缺陷,从而能让O2−在其中传导,已知La为+3价,Ba为+2价,则+3价Co与+4价Co的原子个数比为
您最近一年使用:0次
名校
8 . 下列关于超分子和配合物的叙述中,错误的是
A.利用超分子的分子识别特征,可以用“杯酚”和甲苯、氯仿等分离 和 和 |
B.配合物 中 中 的杂化方式不可能为 的杂化方式不可能为 |
C. 配离子 配离子 中含有的 中含有的 键数目为 键数目为 个 个 |
D. 的八面体配合物 的八面体配合物 与足量 与足量 溶液作用生成 溶液作用生成 沉淀,则 沉淀,则 、 、 、 、 的值分别为1、5、2 的值分别为1、5、2 |
您最近一年使用:0次
2022-05-08更新
|
408次组卷
|
3卷引用:吉林省长春市第八中学2021-2022学年高二下学期线上月考化学试题
21-22高二·全国·课时练习
名校
9 . 下列说法中正确的是
| A.NCl3分子呈三角锥形,这是氮原子采取sp2杂化的结果 |
| B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道 |
| C.中心原子采取sp3杂化的分子,其空间结构可能是四面体形或三角锥形或V形 |
| D.AB3型的分子空间结构必为平面三角形 |
您最近一年使用:0次
2021-12-25更新
|
643次组卷
|
4卷引用:吉林省抚松县第一中学2021-2022学年高二下学期开学考试化学试题
吉林省抚松县第一中学2021-2022学年高二下学期开学考试化学试题吉林省长春外国语学校2021-2022学年高二上学期期末考试化学试题(已下线)2.2.2 杂化轨道理论-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)
名校
10 . 关于σ键和π键的形成过程,说法不正确的是
A. 分子中C原子、N原子的杂化轨道类型分别为sp2、sp3 分子中C原子、N原子的杂化轨道类型分别为sp2、sp3 |
| B.N2分子中的π键为p-pπ键,π键不能绕键轴旋转 |
| C.CH4中的碳原子为sp3杂化,4个sp3杂化轨道分别与氢原子s轨道形成σ键 |
| D.HCl分子中的σ键为两个s轨道“头碰头”重叠形成,没有方向性 |
您最近一年使用:0次



